Цель:
Цель:
Проанализировать эффективность и безопасность нинтеданиба у пациентов с фиброзирующими интерстициальными заболеваниями легких (ИЗЛ), связанными с аутоиммунными заболеваниями, с прогрессирующим фиброзным фенотипом (ПФФ).
Методика:
В исследование INBUILD были включены пациенты с фиброзирующими ИЗЛ, за исключением идиопатического легочного фиброза, у которых были фибротические изменения в легких >10% по данным компьютерной томографии высокого разрешения (КТВР), ожидаемая форсированная жизненная емкость легких (ФЖЕЛ) ≥ 45% и диффузионная способность легких по монооксиду углерода DLCO от ≥30% до <80%. Пациенты соответствовали определяемым в протоколе критериям прогрессирования ИЗЛ в течение 24 месяцев до скрининга. Пациенты были рандомизированы на 2 группы: получающие нинтеданиб или плацебо. Мы оценили скорость снижения ФЖЕЛ (мл/год) и развитие нежелательных явлений (НЯ) в течение 52 недель в подгруппе ИЗЛ, связанными с аутоиммунными заболеваниями.
Результаты:
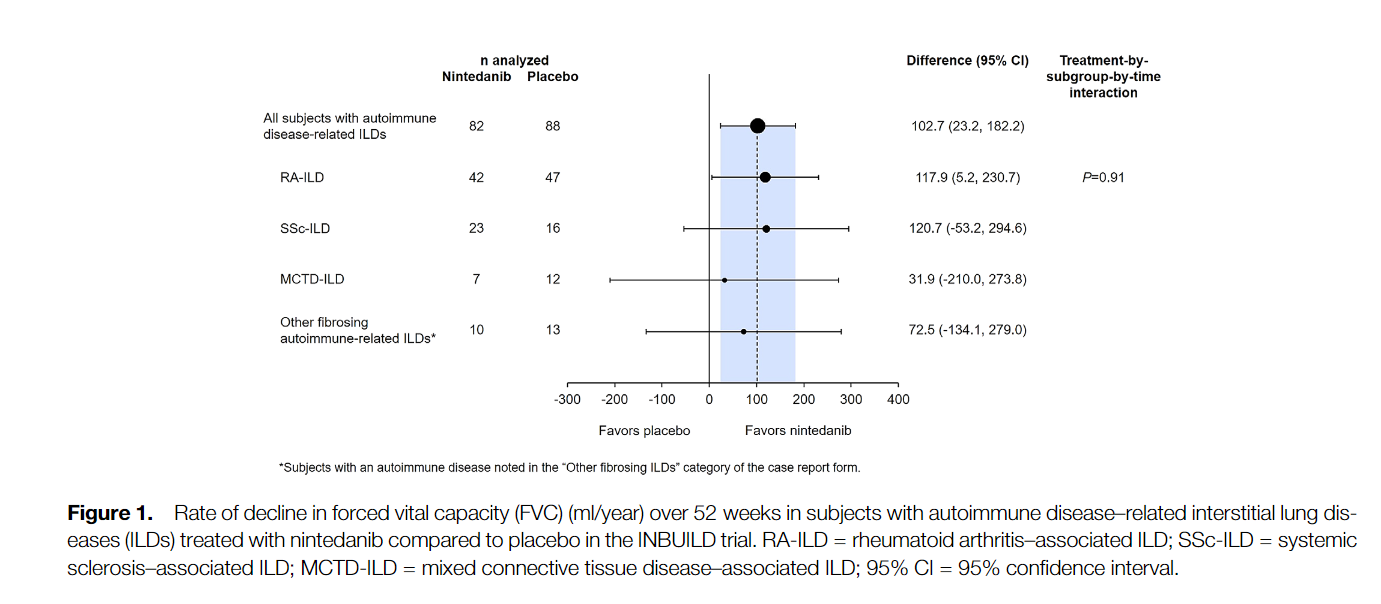
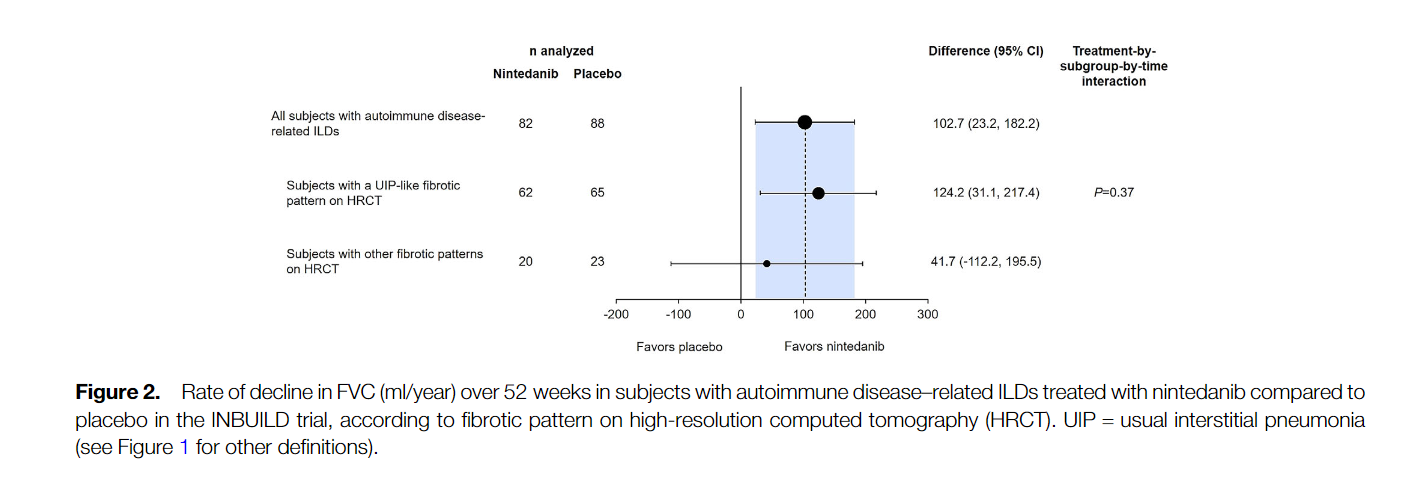
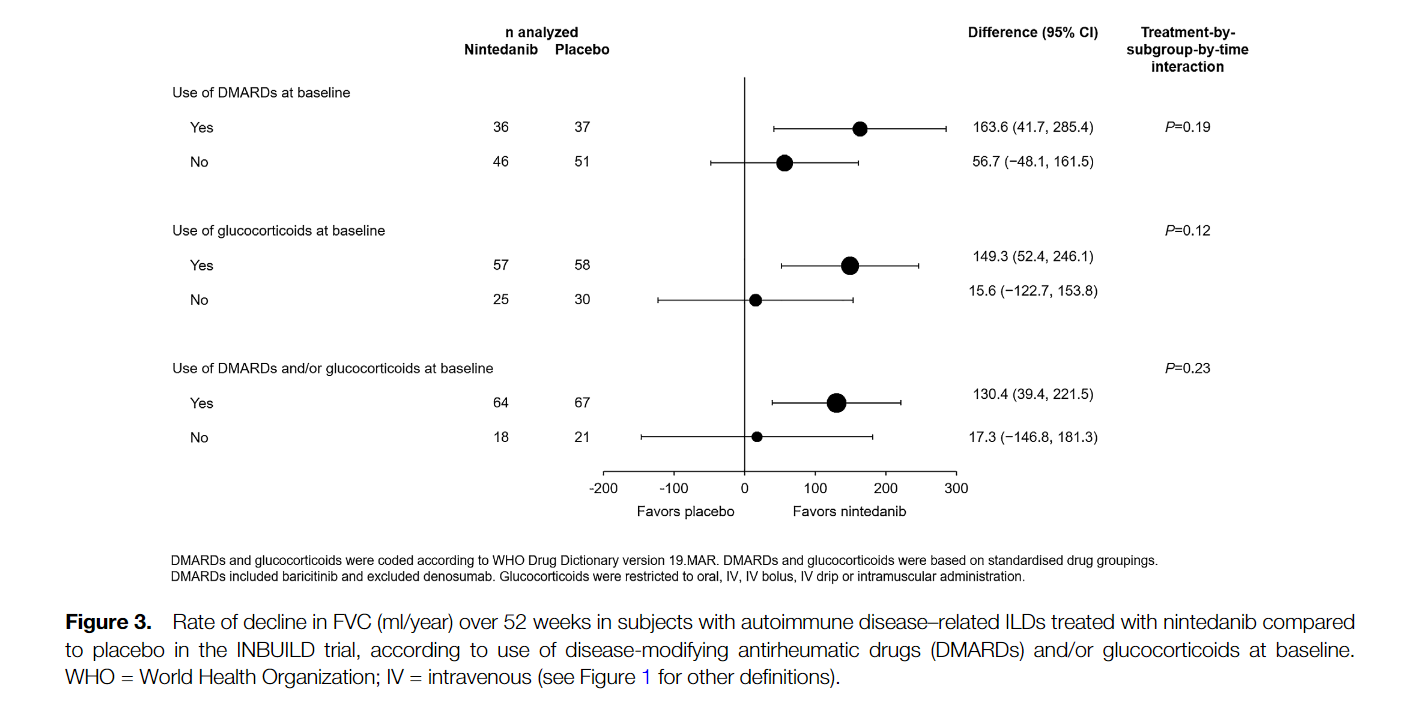
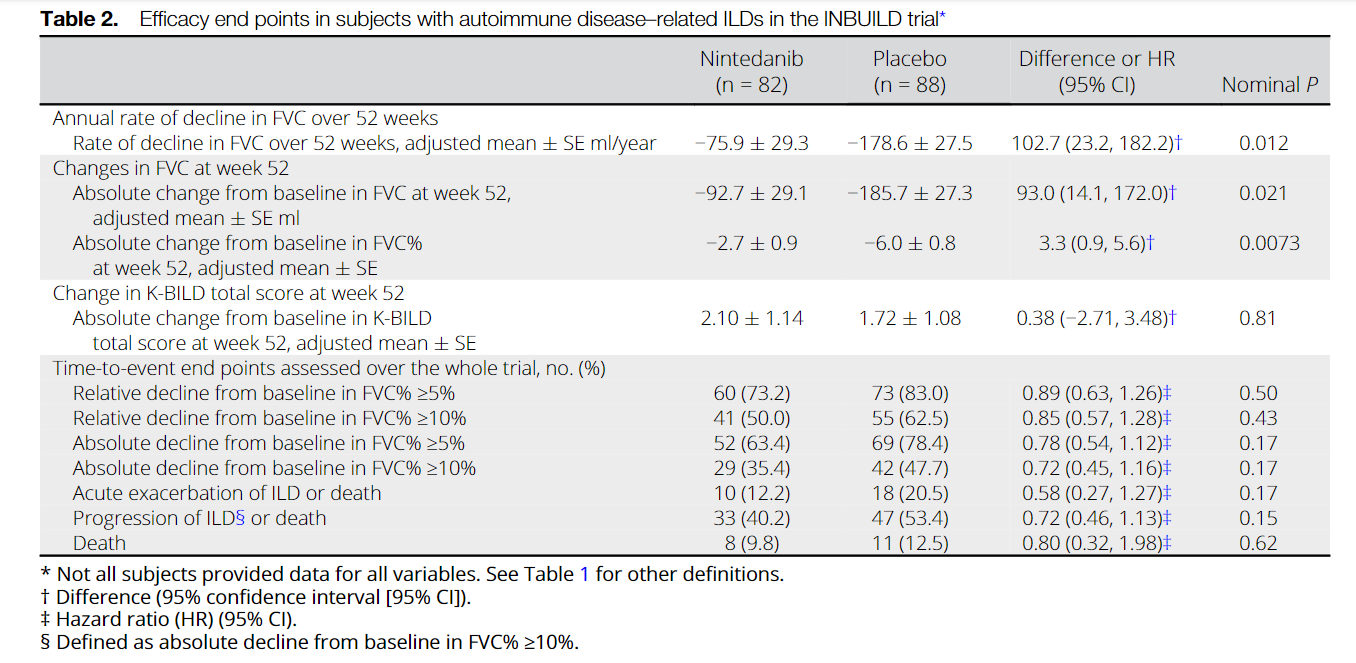
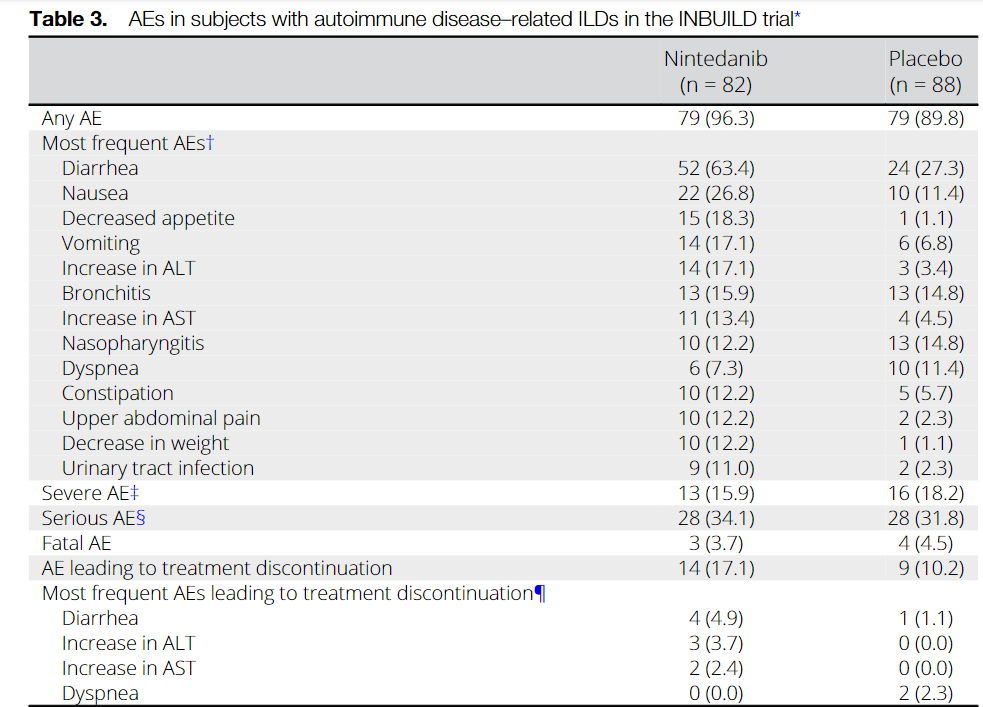
Среди 170 пациентов с ИЗЛ, связанными с аутоиммунными заболеваниями, скорость снижения ФЖЕЛ за 52 недели составила -75,9 мл/год в группе нинтеданиба по сравнению с -178,6 мл/год в группе плацебо (разница 102,7 мл/год [95% доверительный интервал 23,2, 182,2] р = 0,012). В подгруппах ИЗЛ гетерогенности эффекта нинтеданиба по сравнению с плацебо выявлено не было (P = 0,91). Наиболее частым НЯ была диарея, о которой сообщалось у 63,4% и 27,3% пациентов в группах нинтеданиба и плацебо, соответственно. 17,1% в группе нинтеданиба и 10,2% пациентов в группе плацебо прекратили прием исследуемого препарата по причине возникших НЯ.
Выводы:
В исследовании INBUILD нинтеданиб замедлял скорость снижения ФЖЕЛ у пациентов с прогрессирующими фиброзирующими ИЗЛ, связанными с аутоиммунными заболеваниями.
Eric L Matteson, Clive Kelly, Jörg H W Distler, Anna-Maria Hoffmann-Vold and others
Arthritis Rheumatol. 2022 Jun;74(6):1039−1047.
doi: 10.1002/art.42 075.
PMID: 35 199 968
Nintedanib in Patients With Autoimmune Disease-Related Progressive Fibrosing Interstitial Lung Diseases: Subgroup Analysis of the INBUILD Trial
Objective:
To analyze the efficacy and safety of nintedanib in patients with fibrosing autoimmune disease-related interstitial lung diseases (ILDs) with a progressive phenotype.
Methods:
The INBUILD trial enrolled patients with a fibrosing ILD other than idiopathic pulmonary fibrosis, with diffuse fibrosing lung disease of >10% extent on high-resolution computed tomography, forced vital capacity percent predicted (FVC%) ≥45%, and diffusing capacity of the lungs for carbon monoxide percent predicted ≥30% to <80%. Patients fulfilled protocol-defined criteria for progression of ILD within the 24 months before screening, despite management deemed appropriate in clinical practice. Subjects were randomized to receive nintedanib or placebo. We assessed the rate of decline in FVC (ml/year) and adverse events (AEs) over 52 weeks in the subgroup with autoimmune disease-related ILDs.
Results:
Among 170 patients with autoimmune disease-related ILDs, the rate of decline in FVC over 52 weeks was -75.9 ml/year with nintedanib versus -178.6 ml/year with placebo (difference 102.7 ml/year [95% confidence interval 23.2, 182.2]; nominal P = 0.012). No heterogeneity was detected in the effect of nintedanib versus placebo across subgroups based on ILD diagnosis (P = 0.91). The most frequent AE was diarrhea, reported in 63.4% and 27.3% of subjects in the nintedanib and placebo groups, respectively. AEs led to permanent discontinuation of trial drug in 17.1% and 10.2% of subjects in the nintedanib and placebo groups, respectively.
Conclusion:
In the INBUILD trial, nintedanib slowed the rate of decline in FVC in patients with progressive fibrosing autoimmune disease-related ILDs, with AEs that were manageable for most patients.