Что уже известно по этой теме:
Что уже известно по этой теме:
Внутрисуставные инъекции гиалуроновой кислоты используются для лечения остеоартрита коленного сустава на протяжении более 50 лет. Эффективность и безопасность такого лечения до сих пор являются предметом споров. Новые данные указывают на то, что эффект от лечения может быть гораздо меньше, чем ранее сообщалось.
Что это исследование продемонстрировало:
Получены убедительные доказательства, указывающие на то, что инъекции гиалуроновой кислоты приводят к незначительному уменьшению боли при остеоартрите коленного сустава по сравнению с плацебо. Снижение интенсивности боли по сравнению с плацебо в баллах составило -2,0 мм (95% ДИ от -3,8 до -0,5 мм) по 100-мм визуально-аналоговой шкале боли (ВАШ). Из 100 мм всего 2 мм по ВАШ.
Такие же выводы получены и для улучшения функции сустава. Значит ли это, что боль пройдет всего на 2 мм из 100 мм по ВАШ? Нет, это усредненный результат. Также получены доказательства, указывающие на то, что внутрисуставные инъекции гиалуроновой кислоты увеличивают риск серьезных нежелательных явлений по сравнению с плацебо. С учетом полученных результатов широкое применение ГК для лечения остеоартрита коленного сустава не поддерживается.
Цель:
Оценить эффективность и безопасность препаратов гиалуроновой кислоты (ГК) при боли и нарушении функции у пациентов с гонартрозом (остеоартритом коленного сустава).
Дизайн:
систематический обзор и метаанализ
Источники данных:
Поиск проводился в базах данных Medline, Embase и Центральном реестре контролируемых исследований Кохрана с момента создания до 11 сентября 2021. Неопубликованные испытания были взяты из реестров исследований и литературы, не индексированной в медицинских базах данных.
Критерии включения:
Рандомизированные клинические исследования, в которых проводилось сравнение препаратов гиалуроновой кислоты с плацебо или без вмешательства при остеоартрите коленного сустава.
Основные критерии оценки данных:
Предварительно заданной основной конечной точкой эффективности была интенсивность боли. Вторичными конечными точками были улучшение функции сустава и серьезные нежелательные явления (СНЯ). Боль и функция были проанализированы как стандартизованная разность средних значений (стандартное отклонение — MD). Предварительно заданная стандартизованная разность средних значений в группах составила -0,37 SMD. СНЯ были рассмотрены в качестве относительных рисков.
Методы:
Двумя независимыми экспертами были извлечены релевантные данные с использованием инструмента Кокрейновского сотрудничества для оценки риска систематической ошибки. Заданный анализ был на основании только больших плацебо-контролируемых исследований с количеством ≥100 участников в группе. Суммарные результаты были получены с помощью метаанализа на основе модели со случайным эффектом. Также были проведены кумулятивный метаанализ и последовательный анализ исследований в рамках модели случайных эффектов.
Результаты:
Предоставленные данные взяты из 169 клинических исследований с участием 21 163 пациентов. Признаки влияния маленькой выборки в исследовании и систематическая ошибка, связанная с предпочтительной публикацией положительных результатов исследования, наблюдались в отношении боли и функции (тесты Эггера с P<0,001 и асимметричная воронкообразная диаграмма). Двадцать четыре крупных плацебо-контролируемых исследования (8 997 рандомизированных участников), включенных в основной анализ боли показали, что в введение ГК ассоциировалось с небольшим снижением интенсивности боли по сравнению с плацебо (SMD -0,08, 95% ДИ от -0,15 до -0,02), за исключением минимального клинически значимого различия между группами.
Этот эффект соответствует разнице в баллах боли −2,0 мм (95% ДИ от −3,8 до −0,5 мм) 100 мм визуально-аналоговой шкале. Такие же выводы были получены и для улучшения функции сустава. На основании 15 крупных плацебо-контролируемых исследований с участием 6 462 рандомизированных участников, введение ГК было связано со статистически значимым более высоким риском СНЯ по сравнению с плацебо (относительный риск 1,49, 95% ДИ от 1,12 до 1,98).
Выводы:
Убедительные доказательства указывают на то, что введение ГК приводит к небольшому снижению боли при остеоартрите коленного сустава по сравнению с плацебо, но полученная разница меньше минимального клинически значимого различия между группами. Полученные доказательства указывают на то, что введение ГК связано с повышенным риском СНЯ по сравнению с плацебо. С учетом полученных результатов широкое применение ГК для лечения гонартроза не поддерживается.
Tiago V Pereira, Peter Jüni, Pakeezah Saadat, Dan Xing, Liang Yao, Pavlos Bobos, Arnav Agarwal, Cesar A Hincapié, Bruno R da Costa
dx.doi.org/10.1136/bmj‑2022‑69 722
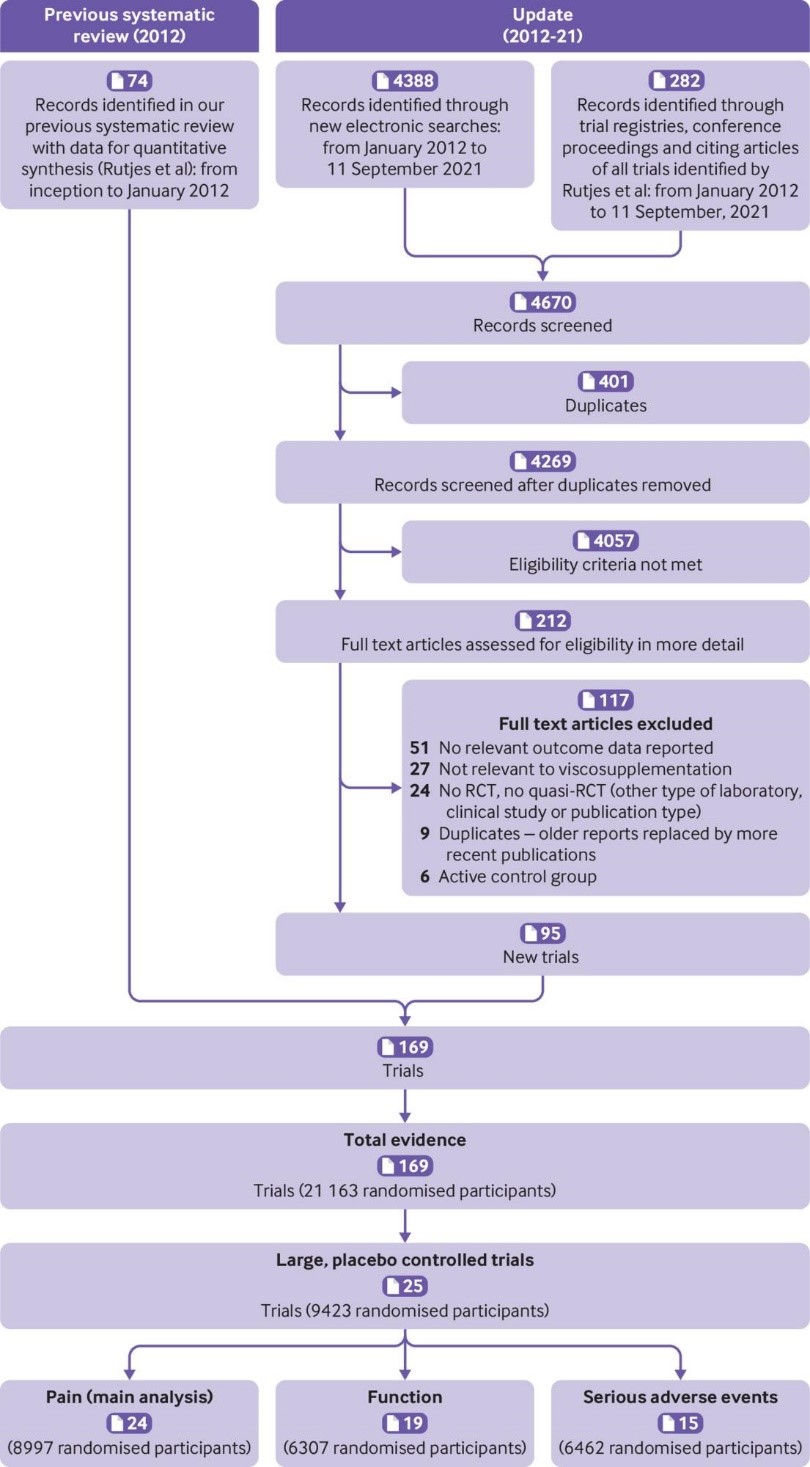
Fig 1 Flowchart showing steps in the selection of relevant trials. RCT=randomised controlled trial

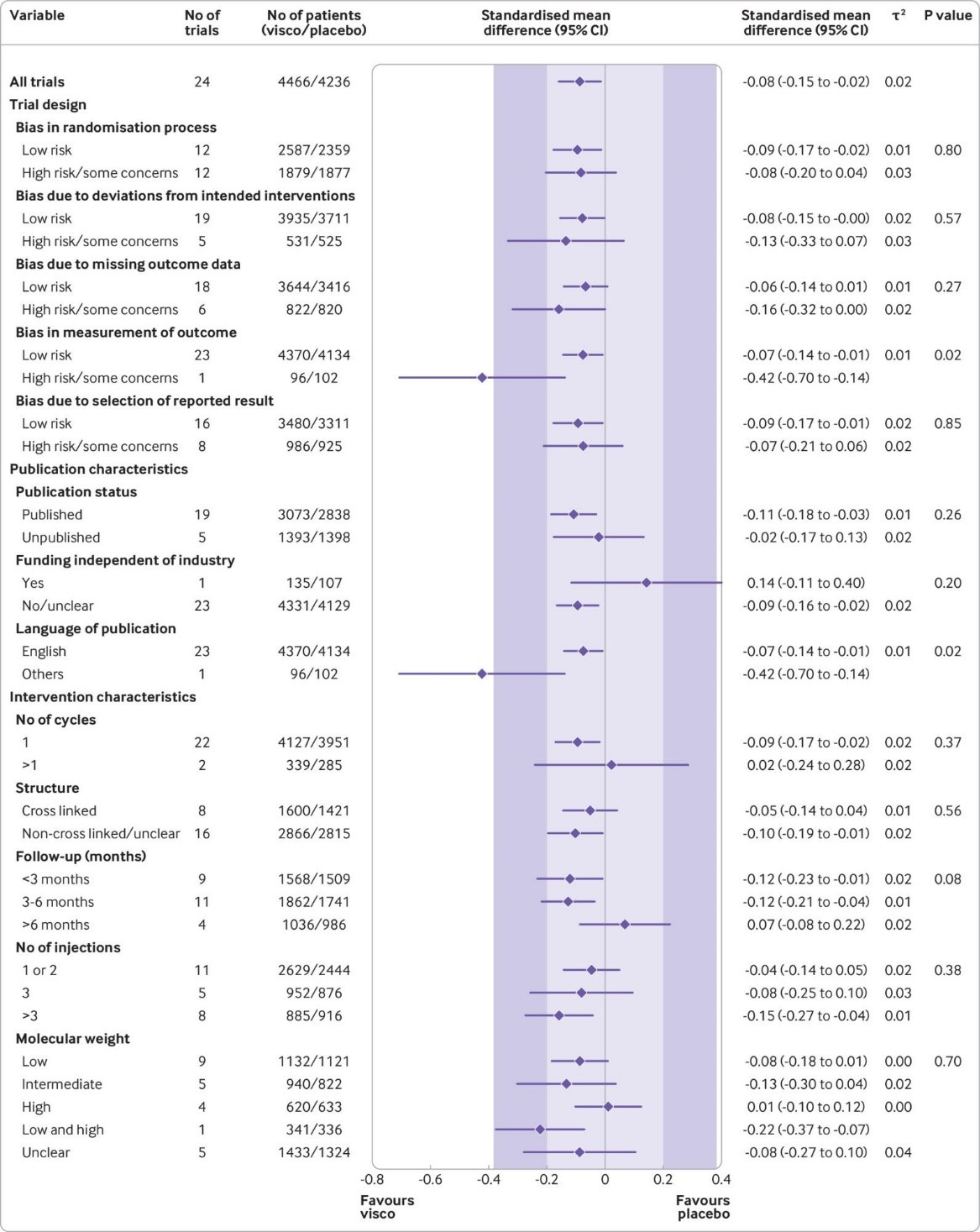
Fig 2 Main and subgroup analyses for pain. Results are based on 24 large, placebo controlled trials, including 8997 randomised participants. The shaded areas represent the areas of clinical equivalence (darker areas represent the minimal clinically important difference of 0.37, lighter areas represent the more stringent 0.2 margin of equivalence). P denotes two tailed P values for interaction (two subgroups only) or trend tests for interaction (three or more subgroups). For the molecular weight categories, the P value was based on a simple interaction test because one trial examined a preparation made of high and low molecular weight hyaluronic acids. Cycles: patients are usually given a single injection or a course of two to six injections; one cycle refers to one such course of treatment. Number of participants analysed (shown for each subgroup) might be smaller than number of randomised participants. A τ2 of up to 0.04 was prespecified to represent low heterogeneity, 0.09 to represent moderate, and 0.16 to represent high statistical heterogeneity among trial estimates.29 visco=viscosupplementation
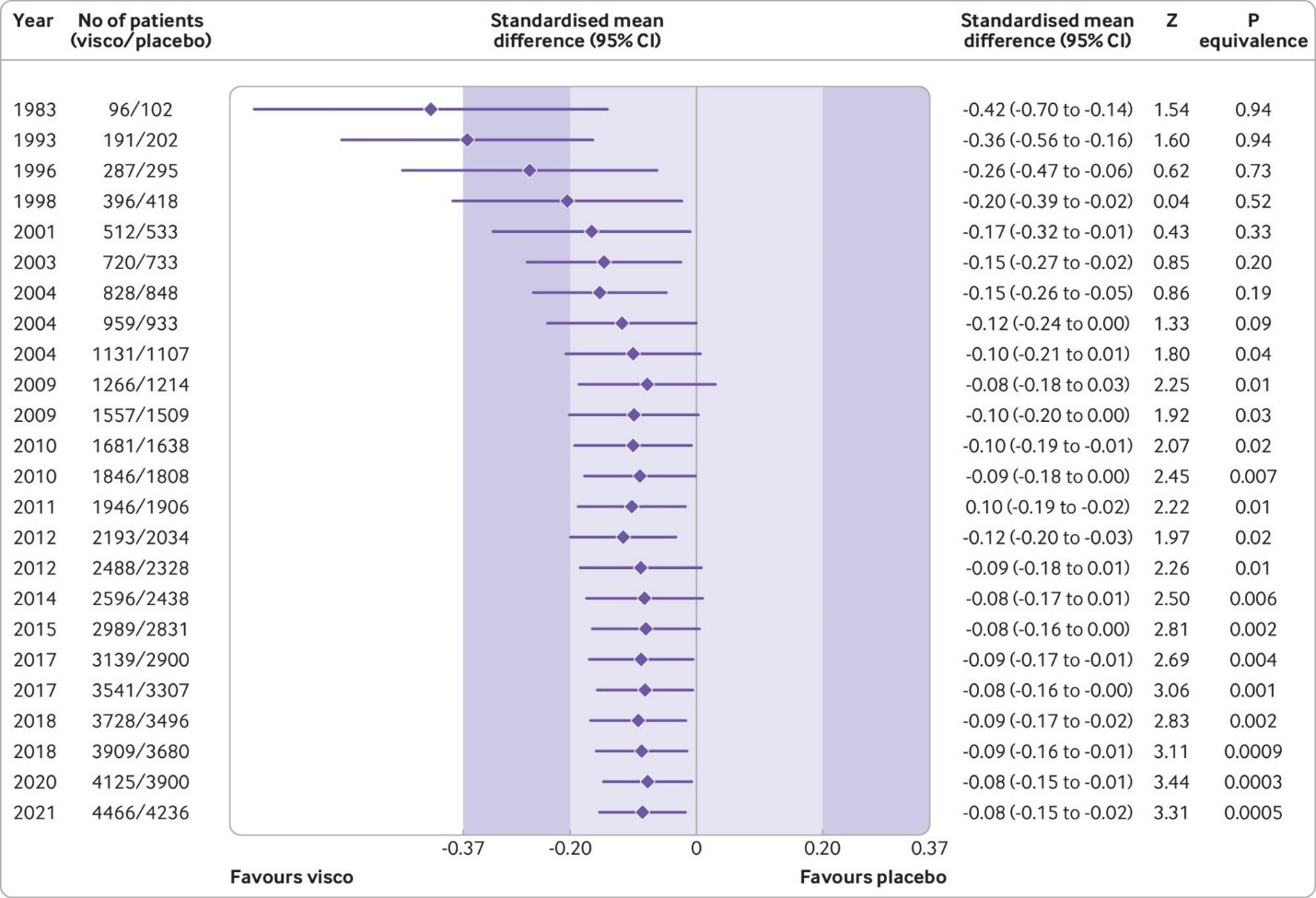
Fig 3 Cumulative pooled analysis for knee pain based on large, placebo controlled trials (n=24 trials, 8997 patients randomised). The shaded areas represent the areas of clinical equivalence (darker areas represent the minimal clinically important difference of 0.37, lighter areas represent the more stringent 0.2 margin of equivalence). Results are for random effects model. Over the years, between trial variance estimates (τ2) varied between 0 and 0.02, suggesting low heterogeneity. P values for equivalence are based on two one sided tests. The number of participants analysed might be smaller than the number of randomised participants
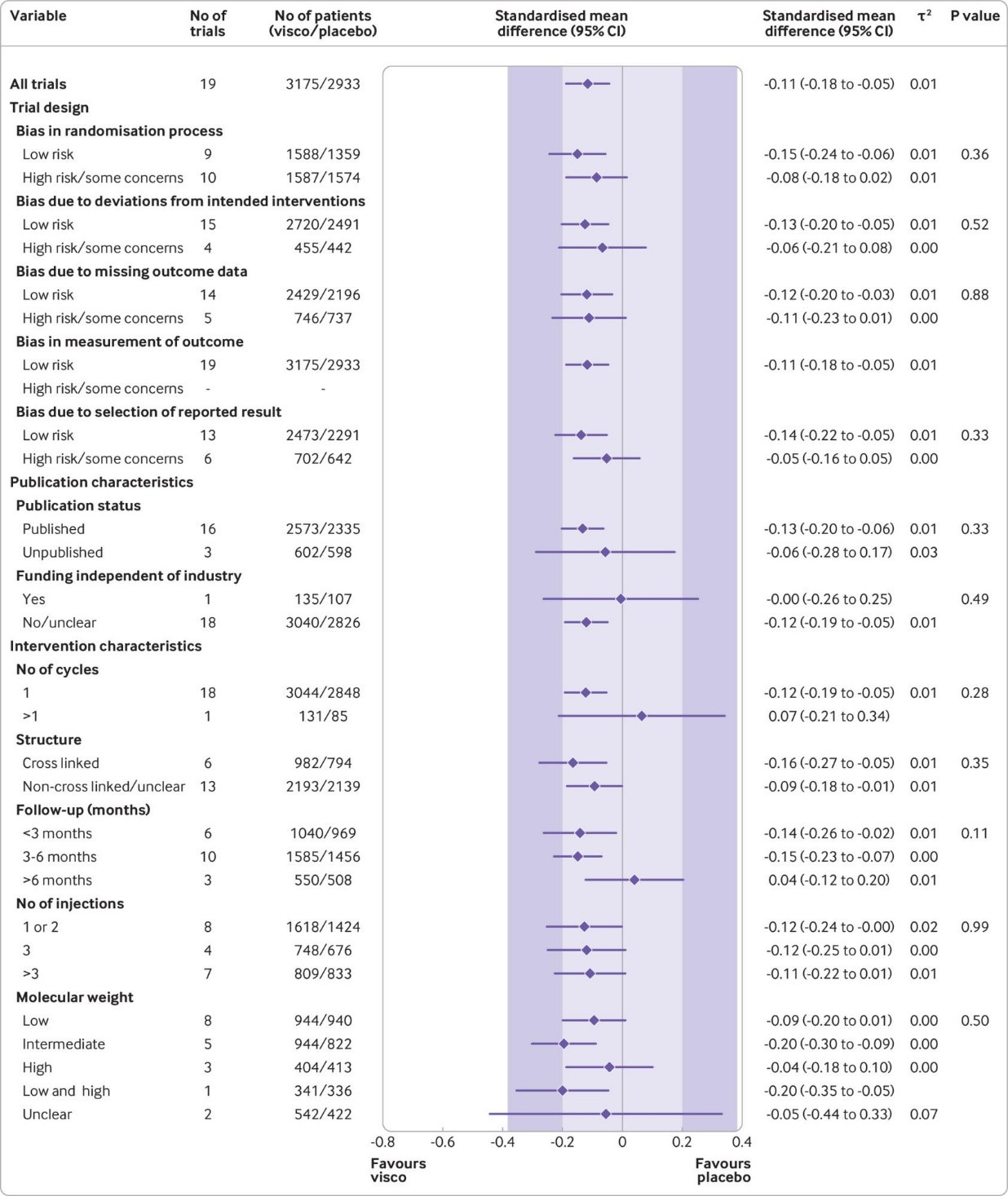
Fig 4 Main and subgroup analyses for function. Results are based on 19 large, placebo controlled trials, including 6307 randomised participants. The shaded areas represent the areas of clinical equivalence (darker areas represent the minimal clinically important difference of 0.37, lighter areas represent the more stringent 0.2 margin of equivalence). P denotes two tailed P values for interaction (two subgroups only) or trend tests for interaction (three or more subgroups). For the molecular weight categories, the P value was based on a simple interaction test because one trial examined a preparation made of high and low molecular weight hyaluronic acids. Cycles: patients are usually given a single injection or a course of two to six injections; one cycle refers to one such course of treatment. Number of participants analysed (shown for each subgroup) might be smaller than number of randomised participants. A τ2 of up to 0.04 was prespecified to represent low heterogeneity, 0.09 to represent moderate, and 0.16 to represent high statistical heterogeneity among trial estimates.29 visco=viscosupplementation
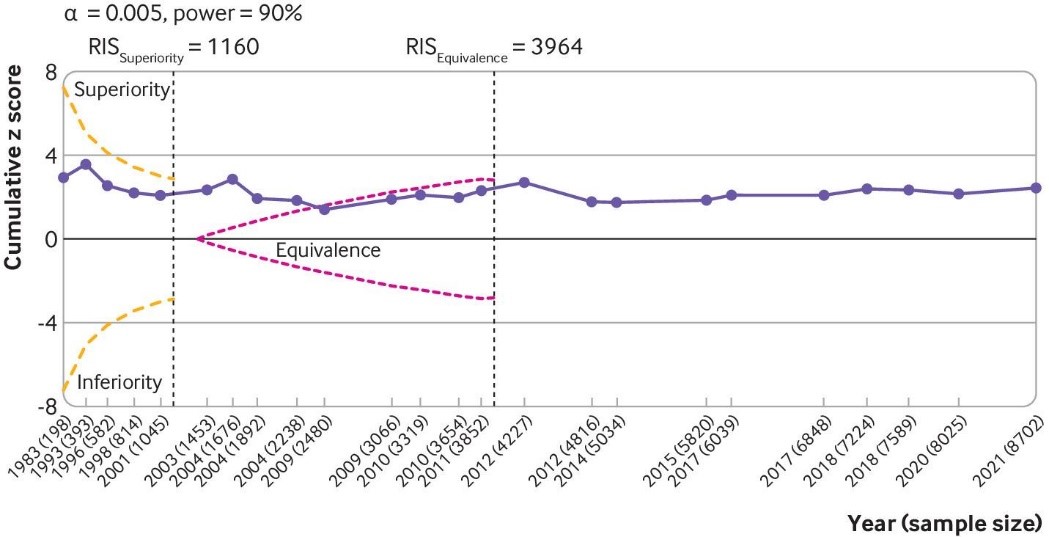
Fig 5 Trial sequential analysis for pain. Results are based on 24 large, placebo controlled trials (8997 randomised participants). Cumulative z scores were calculated under a random effects model. RIS (required information size; vertical lines) detects a minimal clinically important difference of −0.37 with 90% of power at α level of 0.005. O’Brien-Fleming monitoring boundaries are represented by dashed orange lines. The inner wedges (futility boundaries) are shown in pink and represent limits to the equivalence region considering the 0.2 equivalence margin. Circles denote cumulative z score for each additional trial added to the analysis. Between trial variation was accounted for using diversity (D2) index adjusted sample sizes. A D2 of 50% was assumed. Number of participants analysed (shown by year) might be smaller than number of randomised participants
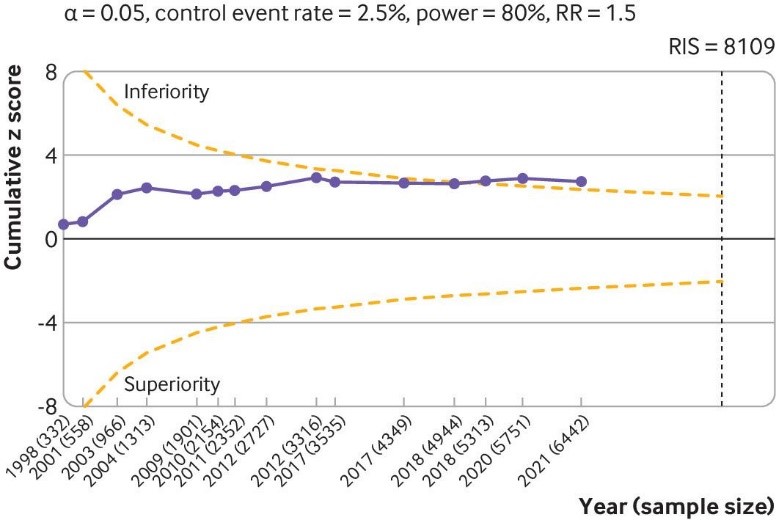
Fig 6 Trial sequential analysis of 15 large placebo controlled trials for serious adverse events. The analysis was based on 6462 randomised participants. Given the weak association between viscosupplementation and pain reduction in knee osteoarthritis, any increase in risk of serious adverse events caused by viscosupplementation compared with placebo can be considered a clinically important increase. Cumulative z scores are calculated under a random effects model. RIS (required information size) was calculated as the sample size that gives a trial 80% power to detect a 50% relative risk (RR) increase of serious adverse events, assuming a control event rate of 2.5% and a two sided α=0.05. O’Brien-Fleming monitoring boundaries are represented by dashed orange lines. Circles denote the z score for each additional trial. A D2 of 25% was assumed. Non-peer reviewed reports had their disclosure year defined as the earliest year in which the document was first officially created (when available within the file), year of online publication (eg, results first posted date on ClinicalTrials.gov), or the date on which the material was made available for review. Number of participants analysed (shown by year) might be smaller than number of randomised participants
Viscosupplementation for knee osteoarthritis: systematic review and meta-analysis
What is already known on this topic
Intra-articular injections of hyaluronic derivatives (viscosupplementation) have been used to treat knee osteoarthritis for over 50 years The effectiveness and safety of this treatment are still a topic of debate Emerging evidence indicates that treatment effects could be smaller than previously reported.
What this study adds
Strong conclusive evidence indicates that viscosupplementation leads to a small reduction in knee osteoarthritis pain compared with placebo, but the difference is less than the minimal clinically important between group difference Strong conclusive evidence also indicates that viscosupplementation increases the risk of serious adverse events compared with placebo. The findings do not support broad use of viscosupplementation to treat knee osteoarthritis.
Objectives:
To evaluate the effectiveness and safety of viscosupplementation for pain and function in patients with knee osteoarthritis.
Design:
Systematic review and meta-analysis of randomized trials.
Data sources:
Searches were conducted of Medline, Embase, and the Cochrane Central Register of Controlled Trials (CENTRAL) databases from inception to 11 September 2021. Unpublished trials were identified from the grey literature and trial registries.
Eligibility criteria for study selection:
Randomised trials comparing viscosupplementation with placebo or no intervention for knee osteoarthritis treatment.
Main outcome measures:
The prespecified primary outcome was pain intensity. Secondary outcomes were function and serious adverse events. Pain and function were analysed as standardised mean differences (SMDs). The prespecified minimal clinically important between group difference was −0.37 SMD. Serious adverse events were analysed as relative risks.
Methods:
Two reviewers independently extracted relevant data and assessed the risk of bias of trials using the Cochrane risk of bias tool. The predefined main analysis was based only on large, placebo controlled trials with ≥100 participants per group. Summary results were obtained through a random effects metaanalysis model. Cumulative meta-analysis and trial sequential analysis under a random effects model were also performed.
Results:
169 trials provided data on 21 163 randomised participants. Evidence of small study effects and publication biases was observed for pain and function (Egger's tests with P<0.001 and asymmetric funnel plots). Twenty four large, placebo controlled trials (8997 randomised participants) included in the main analysis of pain indicated that viscosupplementation was associated with a small reduction in pain intensity compared with placebo (SMD −0.08, 95% confidence interval −0.15 to −0.02), with the lower bound of the 95% confidence interval excluding the minimal clinically important between group difference.
This effect corresponds to a difference in pain scores of −2.0 mm (95% confidence interval −3.8 to −0.5 mm) on a 100 mm visual analogue scale. Trial sequential analysis for pain indicated that since 2009 there has been conclusive evidence of clinical equivalence between viscosupplementation and placebo. Similar conclusions were obtained for function. Based on 15 large, placebo controlled trials on 6462 randomised participants, viscosupplementation was associated with a statistically significant higher risk of serious adverse events than placebo (relative risk 1.49, 95% confidence interval 1.12 to 1.98).
Conclusions:
Strong conclusive evidence indicates that viscosupplementation leads to a small reduction in knee osteoarthritis pain compared with placebo, but the difference is less than the minimal clinically important between group difference. Strong conclusive evidence indicates that viscosupplementation is also associated with an increased risk of serious adverse events compared with placebo. The findings do not support broad use of viscosupplementation for the treatment of knee osteoarthritis.
Systematic review registration:
PROSPERO CRD42021236894