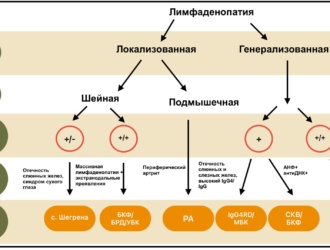
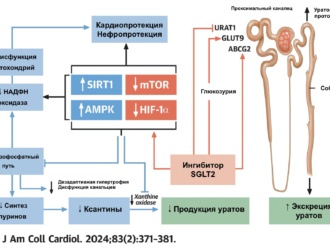
Предпосылки
Предпосылки
Профилактика гиперурикемии (ГУ) играет решающую роль в профилактике подагры. В связи с чем понимание причинно-следственной связи и относительного вклада различных факторов риска в развитие ГУ имеет важное значение. В настоящем исследовании оценивался дополнительный вклад в риск развития ГУ таких факторов как генетическая предрасположенность, диета, уратснижающая терапия (УСТ) и другие. Для оценки причинно-следственной связи диеты с уровнем мочевой кислоты была использована менделевская рандомизация.
Методика
Из базы данных генотипов и фенотипов (ARIC, FHS, CARDIA, CHS) и Британского Биобанка были получены четыре выборки европейского происхождения: три из общей популяции (n = 419 060) и одна из числа пациентов с подагрой (n = 6781). Дихотомизированные переменные, такие как воздействие диеты, генетические варианты риска, ИМТ, потребление алкоголя, лечение диуретиками, пол и возраст использовались для расчета скорректированных популяционных и средних дополнительных долей риска (PAF/AAF) для ГУ (≥0,42 ммоль/л [≥7 мг/дл]). В когорте пациентов с подагрой также оценивалось воздействие УСТ. По данным Британского Биобанка был проведен двухвыборочный менделевский рандомизационный анализ с использованием генетических вариантов, связанных с диетическим паттерном, в качестве воздействия и уровня мочевой кислоты в сыворотке крови в качестве результата.
Результаты
Соблюдение диетических рекомендаций, ИМТ (< 25 кг/м2) и отсутствие аллеля SLC2A9 rs12498742, повышающего уровень мочевой кислоты, приводили к появлению PAF для ГУ от 20 до 24%, от 59 до 69% и от 57 до 64% соответственно в трех когортах без подагры. В когорте подагры PAF для диеты, ИМТ, SLC2A9 rs12498742 и УСТ в отношении ГУ составили 12%, 49%, 48% и 63% соответственно. Менделевская рандомизация продемонстрировала слабое причинно-следственное влияние четырех пищевых привычек на уровень мочевой кислоты в сыворотке крови (например, предпочтительное употребление обезжиренного молока увеличило уровень мочевой кислоты, β = 0,047 ммоль/л, Р = 3,78 × 10-8). Эти влияния были опосредованы ИМТ и не были значимыми (Р ≥ 0,06) в многомерных моделях, оценивающих независимое от ИМТ влияние диеты на уровень мочевой кислоты.
Выводы
Диета оказывает относительно незначительное влияние на уровень мочевой кислоты в сыворотке крови и ГУ. При подагре применение УСТ было самой большой проверенной для ГУ дополнительной долей риска.
Ruth K G Topless, Tanya J Major, Jose C Florez, Joel N Hirschhorn, Murray Cadzow, Nicola Dalbeth, Lisa K Stamp, Philip L Wilcox, Richard J Reynolds , Joanne B Cole, Tony R Merriman
Arthritis Res Ther. 2021 Mar 4; 23 (1): 75
doi: 10.1186/s13075-021-02444-8
PMID: 33663556
PMCID: PMC7931603
The comparative effect of exposure to various risk factors on the risk of hyperuricaemia: diet has a weak causal effect
Background
Prevention of hyperuricaemia (HU) is critical to the prevention of gout. Understanding causal relationships and relative contributions of various risk factors to hyperuricemia is therefore important in the prevention of gout. Here, we use attributable fraction to compare the relative contribution of genetic, dietary, urate-lowering therapy (ULT) and other exposures to HU. We use Mendelian randomisation to test for the causality of diet in urate levels.
Methods
Four European-ancestry sample sets, three from the general population (n = 419,060) and one of people with gout (n = 6781) were derived from the Database of Genotypes and Phenotypes (ARIC, FHS, CARDIA, CHS) and UK Biobank. Dichotomised exposures to diet, genetic risk variants, BMI, alcohol, diuretic treatment, sex and age were used to calculate adjusted population and average attributable fractions (PAF/AAF) for HU (≥0.42 mmol/L [≥7 mg/dL]). Exposure to ULT was also assessed in the gout cohort. Two sample Mendelian randomisation was done in the UK Biobank using dietary pattern-associated genetic variants as exposure and serum urate levels as outcome.
Results
Adherence to dietary recommendations, BMI (< 25 kg/m2), and absence of the SLC2A9 rs12498742 urate-raising allele produced PAFs for HU of 20 to 24%, 59 to 69%, and 57 to 64%, respectively, in the three non-gout cohorts. In the gout cohort, diet, BMI, SLC2A9 rs12498742 and ULT PAFs for HU were 12%, 49%, 48%, and 63%, respectively. Mendelian randomisation demonstrated weak causal effects of four dietary habits on serum urate levels (e.g. preferentially drinking skim milk increased urate, β = 0.047 mmol/L, P = 3.78 × 10-8). These effects were mediated by BMI, and they were not significant (P ≥ 0.06) in multivariable models assessing the BMI-independent effect of diet on urate.
Conclusions
Diet has a relatively minor role in determining serum urate levels and HU. In gout, the use of ULT was the largest attributable fraction tested for HU.