Абстракт
КО — ксантиноксидаза
ШГР — шкала генетического риска
РКИ — рандомизированное клиническое исследование
УСП — уратснижающие препараты
ХБП — хроническая болезнь почек
НПВП — нестероидные противовоспалительные препараты
РМК — растворимая мочевая кислота
МНУ — моноурат натрия
ХПН — хроническая почечная недостаточность
NHANES — Национальная программа проверки здоровья и питания (США)
 Подагра — наиболее широко распространенный во всем мире воспалительный артрит, который связан с сердечно-сосудистыми и почечными заболеваниями и является независимым предиктором преждевременной смерти. Как было неоднократно показано, у больных подагрой чаще развиваются ожирение, хроническая болезнь почек (ХБП), гипертензия, сахарный диабет 2-го типа, дислипидемия, заболевания сердца (включая ишемическую болезнь сердца, сердечную недостаточность и мерцательную аритмию), инсульт и заболевания периферических артерий. Поэтому скрининг и коррекция этих нарушений, так и факторов риска сердечно-сосудистых заболеваний имеют огромное значение. Сопутствующие заболевания, особенно ХБП, и лекарства, прописанные для их лечения, также влияют на ведение больных с подагрой. Многочисленные эпидемиологические исследования показали наличие связи бессимптомной гиперурикемии с вышеупомянутыми болезнями и факторами риска сердечно-сосудистых заболеваний. В исследованиях на животных удалось показать механизм токсического воздействия растворимых уратов плазмы крови на сосуды. Однако причинная связь остается сомнительной, потому что результаты эпидемиологических исследований можно объяснить искажающими факторами, обратной причинной связью или распространенными этиологическими факторами. Недавние исследования с менделевской рандомизацией и исследования различных терапевтических подходов не внесли ясности в этот вопрос. Все еще требуются крупные плацебо-контролируемые исследования для оценки пользы лечения бессимптомной гиперурикемии.
Подагра — наиболее широко распространенный во всем мире воспалительный артрит, который связан с сердечно-сосудистыми и почечными заболеваниями и является независимым предиктором преждевременной смерти. Как было неоднократно показано, у больных подагрой чаще развиваются ожирение, хроническая болезнь почек (ХБП), гипертензия, сахарный диабет 2-го типа, дислипидемия, заболевания сердца (включая ишемическую болезнь сердца, сердечную недостаточность и мерцательную аритмию), инсульт и заболевания периферических артерий. Поэтому скрининг и коррекция этих нарушений, так и факторов риска сердечно-сосудистых заболеваний имеют огромное значение. Сопутствующие заболевания, особенно ХБП, и лекарства, прописанные для их лечения, также влияют на ведение больных с подагрой. Многочисленные эпидемиологические исследования показали наличие связи бессимптомной гиперурикемии с вышеупомянутыми болезнями и факторами риска сердечно-сосудистых заболеваний. В исследованиях на животных удалось показать механизм токсического воздействия растворимых уратов плазмы крови на сосуды. Однако причинная связь остается сомнительной, потому что результаты эпидемиологических исследований можно объяснить искажающими факторами, обратной причинной связью или распространенными этиологическими факторами. Недавние исследования с менделевской рандомизацией и исследования различных терапевтических подходов не внесли ясности в этот вопрос. Все еще требуются крупные плацебо-контролируемые исследования для оценки пользы лечения бессимптомной гиперурикемии.
Вступление (background)
Подагра — распространенное заболевание, встречаемость которого растет во всем мире [1]. Наряду с мучительной подагрической болью подагра связана с преждевременной смертью [2], традиционно объясняемой высокой частотой сопутствующих заболеваний, особенно заболеваний почек и сердечно-сосудистой системы [3]. Сопутствующие заболевания должны учитываться при ведении пациентов с подагрой, потому что они влияют на продолжительность жизни пациента и усложняют лечение. Эти сопутствующие заболевания также часто ассоциированы с бессимптомной гиперурикемией, состоянием еще более распространенным, чем подагра [4], и их причинно-следственная связь с гиперурикемией создает существенные терапевтические трудности.
Сопутствующие заболевания сердечно-сосудистой системы и почек при подагре
Связь подагры с сердечно-сосудистыми и почечными заболеваниями, на которую обратили внимание уже в конце девятнадцатого века [5], в настоящее время хорошо установлена. Распространенность сопутствующих заболеваний возрастает с продолжительностью подагры [6]; подагра также может сопровождаться всеми компонентами метаболического синдрома [7]. Часто выявляется артериальная гипертензия; по данным третьей Национальной программы проверки здоровья и питания (NHANES), распространенность гипертензии составила 69,1% (95% ДИ: 59,4–78,8) и 30,3% (95% ДИ: 28,4–32,2) у пациентов с подагрой и без, соответственно [7]. Проспективные исследования постоянно показывали повышенный риск подагры у пациентов с повышенным давлением [8,9], и недавнее Сингапурское исследование состояния здоровья китайцев также показало повышенный риск гипертензии у лиц с подагрой [10].
По данным третьей программы NHANES, у больных подагрой абдоминальное ожирение встречалось чаще, чем у лиц без подагры: 62,9% (95% ДИ: 50,9-74,8) против 35,3% (95% ДИ: 33,7-46,9) [7]. Кроме того, риск подагры увеличивается с ожирением [8]. Индекс массы тела (ИМТ) и окружность талии коррелируют с уровнем мочевой кислоты в крови [11], и недавно было показано, что ожирение также способствует гиперурикемии [11].
У больных подагрой увеличена распространенность сахарного диабета 2-го типа; по данным третьей программы NHANES, у больных подагрой сахарный диабет встречался чаще, чем у лиц без подагры: 33,1% (95% ДИ: 28,8–41,4) против 10,8% (95% ДИ: 9,9–11,8). В проспективных исследованиях подагра также увеличивала риск сахарного диабета 2-го типа [12, 13], тогда как диабет снижал риск развития подагры [13]; последние данные объясняются тем, что глюкозурия увеличивает выведение уратов с мочой [14]. Более низкая заболеваемость подагрой при диабете 2-го типа частично объясняется частым назначением метформина, который может привести к противовоспалительному эффекту посредством модуляции различных клеточных патогенетических механизмов, включая АМФ-активируемую протеинкиназу, протеинкиназу A и рецепторы, активируемые пероксисомными пролифераторами (PPAR-гамма) [15,16].
У больных подагрой также чаще встречается гипертриглицеридемия: 53,7% (95% ДИ: 42,9–64,4) против 27,9% (95% ДИ: 25,5–30,3) у лиц без подагры [7], и недавнее исследование с менделевской рандомизацией показало, что это нарушение ведет к гиперурикемии [17]. По данным третьей программы NHANES, у больных подагрой чаще, чем у лиц без подагры, повышался холестерин липопротеинов низкой плотности: 47,4% (95% ДИ: 37,2–57,6) против 36,6% (95% ДИ: 34,1–39,1).
Недавний метаанализ шести исследований [18] показал, что 24% (95% ДИ: 15–28) больных подагрой страдают хронической болезнью почек (ХБП) стадии 3 или выше. При нарушении функции почек снижается экскреция уратов с мочой и увеличивается риск развития подагры. В большой немецкой когорте пациентов с ХБП [19] показано, что при снижении расчетной скорости клубочковой фильтрации
с 60 мл/мин/1,73 м2 до 30 мл/мин/1,73 м2 распространенность подагры повышается с 16,0% до 35,6%. И наоборот, у больных с подагрой был увеличен риск терминальной почечной недостаточности [20]. Это может быть объяснено формированием кристаллов мочевой кислоты в почечных трубочках [21], интерстициальным нефритом, осложняемым почечными камнями, отложением кристаллов в мозговом слое почки [22], использованием нестероидных противовоспалительных препаратов (НПВП), частой сопутствующей гипертензией или возможной почечной токсичностью растворимой мочевой кислоты (РМК) [23].
Различные заболевания сердца независимо друг от друга связаны с подагрой [24] и, следовательно, с повышением риска смерти от сердечно-сосудистых причин [25–27]. В большой когорте больных подагрой сердечно-сосудистые заболевания были причиной более чем половины смертельных случаев, и сердечно-сосудистая смертность увеличивалась со степенью тяжести подагры [27]. Гиперурикемия также может
вносить частичный вклад в повышенный риск сердечно-сосудистых заболеваний у больных подагрой, как обсуждается ниже. Однако скорректированный по нескольким показателям риск сердечно-сосудистых заболеваний при подагре более важен и объективен, чем у лиц с бессимптомной гиперурикемией. Представляется, что важную роль играет связанное с кристаллами воспаление [28], по аналогии с повышением риска при ревматоидном артрите, псориатическом артрите или анкилозирующем спондилоартрите. Скорректированный риск ишемической болезни сердца при подагре увеличен как у мужчин [26, 29] так и у женщин [30]. Сердечная недостаточность связана с подагрой [31] и гиперурикемией, которая обостряется на фоне применения мочегонных средств и является маркером неблагоприятного исхода [32]. Риск мерцательной аритмии при подагре увеличен, и распространенность мерцательной аритмии у больных подагрой составляет 7,4% (95% ДИ: 7,2–7,6), по результатам недавнего анализа большой британской базы данных [33]. Также недавно была выявлена связь подагры с аортальным стенозом [34]. Кроме того, подагра повышает скорректированный риск ишемического инсульта и заболеваний периферических сосудов [24]. Наш кластерный анализ показал, что ожирение у больных подагрой преимущественно связанно с гипертензией, сахарным диабетом 2-го типа и дислипидемией, тогда как сердечно-сосудистые болезни и ХБП часто встречаются у больных, которым назначают больше мочегонных препаратов [35].
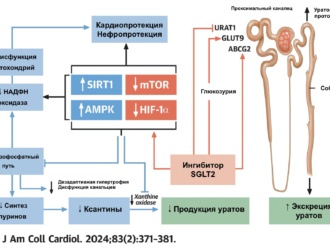
Гиперурикемия и заболевания сердечно-сосудистой системы и почек
Связь гиперурикемии с сердечно-сосудистыми заболеваниями перепроверили после того, как 15 лет назад на животных моделях было показано, что гиперурикемия может вызывать развитие заболеваний сосудов. У грызунов гиперурикемия, вызванная путем ингибирования уриказы [36], диеты богатой фруктозой [37] или удаления транспортера уратов — кишечного транспортера глюкозы 9 (GLUT9) приводила к появлению признаков метаболического синдрома и развитию почечного атеросклероза. Многие из этих проявлений, особенно развитие гипертензии, удавалось предотвратить ранним применением уратснижающих препаратов (УСП). Кроме того, гиперурикемия активировала ренин-ангиотензиновую систему, снижала активность синтазы оксида азота, стимулировала пролиферацию клеток гладких мышц кровеносных сосудов и способствовала развитию инсулинорезистентности. Таким образом было получено представление о механизме, по которому растворенная внутри клетки мочевая кислота может повреждать эндотелий и стенки артерий, в противопоставление ее классическим антиоксидантным свойствам, которые, как теперь считается, ограничены ее внеклеточным эффектом [5]. Более того, недавно было обнаружено, что у людей гиперурикемия сопровождается увеличенными уровнями липидов и уменьшением объема соединительной ткани. Это может делать бляшку менее стабильной [39, 40] и, возможно, опосредовать обструкцию артерий. В другом исследовании в шести заспиртованных коронарных артериях от 55 эксплантированных сердец были найдены двоякопреломляющие кристаллы, что позволяет говорить о способности кристаллов моноурата натрия (МУН) вызывать воспаление в коронарных артериях [41].
В большом количестве эпидемиологических исследований изучалась связь между гиперурикемией и исходами сердечно-сосудистых и почечных заболеваний [28, 42]. Результаты этих исследований позволяют предположить наличие связи между гиперурикемией и повышенной смертностью от сердечно-сосудистых причин [43], повышенной распространенностью ишемической болезни сердца [44], сердечной недостаточности, мерцательной аритмии [45] и инсульта [46]. Недавнее исследование по методу поперечного среза показало, что у пациентов с гиперурикемией и бессимптомным отложением кристаллов МУН ишемическая болезнь сердца может протекать тяжелее, чем у пациентов с нормальным или повышенным уровнем мочевой кислоты без отложений кристаллов [47]. Проспективные когортные исследования показали, что гиперурикемия приводит к гипертензии [48], которая, как недавно выяснили, на фоне гиперурикемии имеет более рефрактерный характер [49,50], к почечной недостаточности [23], сахарному диабету 2-го типа [51] и метаболическому синдрому [52]. Однако эти впечатляющие результаты не доказывают причинно-следственную связь, потому что наблюдаемые связи можно было бы объяснить искажающими факторами, обратной причинной связью или распространенными этиологическими факторами. Так как гиперурикемия связана с многочисленными факторами риска сердечно-сосудистых заболеваний, неблагоприятные исходы могут полностью объясняться искажающими факторами, как в исследовании сердечно-сосудистых заболеваний Framingham Heart Study [3]. Большинство более поздних исследований показали связь между гиперурикемией и плохими исходами сердечно-сосудистых заболеваний, несмотря на многократную поправку на сердечно-сосудистые факторы риска [43]. Однако поправки были часто неполными: в некоторых исследованиях не учитывали ИМТ, курение, инсулинорезистентность и функцию почек.
Кроме того, не были приняты во внимание диетические факторы, связанные с гиперурикемией и возможно повышающие риск смерти (например, злоупотребление алкоголем). Несмотря на временную связь (было показано, что гиперурикемия предшествовала гипертензии, ХБП и метаболическому синдрому), нельзя исключить обратную причинно-следственную связь. Действительно, гиперурикемию могли объяснить невыявленные легкая почечная дисфункция или гиперинсулинемия. Например, семейные ювенильные гиперурикемические нефропатии впервые выявлялись у молодых пациентов с ранней подагрой/гиперурикемией и предшествовали тяжелой почечной недостаточности. Раннее назначение аллопуринола защищало некоторых пациентов от почечной недостаточности, наблюдаемой при болезни, то есть можно сделать вывод, что причиной почечной дисфункции была гиперурикемия. В настоящее время по результатам генетических исследований установлено, что болезнь имеет почечное происхождение и обусловлена наличием нескольких вариантов гена уромодулина или ядерного фактора гепатоцитов 1 b [53]. Описанный эффект аллопуринола теперь представляется неспецифическим нефропротективным действием, наблюдаемым при различных нефропатиях (см. ниже).
Причинно-следственная связь между гиперурикемией и сердечно-сосудистыми заболеваниями по-прежнему неясна, и это побудило многих исследователей использовать менделевскую рандомизацию для изучения эффектов различных вариантов генов, опосредующих обмен уратов, на различные сердечно-сосудистые исходы [11]. Менделевская рандомизация позволяет сравнивать сердечно-сосудистые показатели у пациентов с гиперурикемическими генами и без таковых. Поскольку эти гены распределяются во время мейоза случайным образом, искажающие факторы должны быть равномерно распределены между участниками исследования с гиперурикемическими генами и без них, как в рандомизированном клиническом исследовании. Это позволяет избавиться от внесения поправок в статистический анализ и связанной с ними неопределенности. Кроме того, генетические варианты не зависят от состояния здоровья, и исключается возможность обратной причинно-следственной связи [54]. Хотя наследственность имеет большее значение в развитии гиперурикемии, чем подагры [55], наследственных факторов развития гиперурикемии множество [56], они все еще мало изучены и объясняют только малую часть изменчивости уровня мочевой кислоты в крови, особенно когда варианты гиперурикемических генов рассматривают индивидуально.
Все это вызывает риск недостаточной мощности исследований. В большинстве первых исследований в качестве инструментального показателя использовали варианты гена 9-го члена 2-го семейства переносчиков растворенных веществ (SLC2A9), который кодирует транспортер GLUT9 и обуславливает 3,5% изменчивости уровня мочевой кислоты у мужчин и до 15% — у женщин [57] (Таблица 1). Исследования небольших выборок амишей и лиц из южной Италии, представляющих относительно гомогенные популяции, подтвердило причинную роль гиперурикемии в развитии гипертензии [58, 59], атеросклероза [60] или почечной недостаточности [61]. Однако исследование двух больших датских когорт не показало причинную связь с ишемической болезнью сердца и гипертензией [62], и дальнейшее исследование не нашло доказательства связи между гиперурикемией и метаболическим синдромом [63].
В других исследованиях с целью увеличения генетического воздействия на уровень мочевой кислоты использовали показатели генетического риска (ПГР), которые позволяют учитывать вклад каждого гена в развитие гиперурикемии, (Таблицы 2 и 3). Два исследования подтвердили причинную связь со смертью от сердечно-сосудистых заболеваний, внезапной сердечной смертью [64] и диабетической макроангиопатией [65]. Однако во многих исследованиях [17, 66–72], даже с большей мощностью, были сделаны противоположные выводы, несмотря на то что в двух из них показана связь ПГР с подагрой [66, 71] (Таблица 3). В когорте из Роттердама показана отрицательная связь между гиперурикемическим ПГР и артериальным давлением, особенно сильная у пациентов, получающих мочегонные средства [69]. Использование нескольких вариантов генов в ПГР увеличивало вероятность того, что некоторые включенные гены (или гены с неслучайным распределением во время мейоза) имели эффекты, отличные от воздействия на уровень растворимой мочевой кислоты (РМК). Это явление называется плейотропией и может быть важным отрицательным фактором. Плейотропию считали объяснением того факта, что гиперурикемический ПГР, состоящий из 5 вариантов гена почечного транспортера, был связан с сохранением, а не с ухудшением почечной функции, как было показано во многих эпидемиологических исследованиях [68]. В более поздних исследованиях постарались учитывать плейотропию, в том числе путем исключения генов, которые представлялись плейотропическими по результатам анализа биологических (т.е. уровня липидов) или клинических параметров (т.е. артериального давления, ИМТ) в изученных когортах [65, 71], внесения поправки на искажающие факторы [72], или используя регрессию по Egger, которая позволяет учесть скрытую плейотропию [72]. Таким образом, несмотря на некоторые противоречивые результаты [64, 65], исследования с менделевской рандомизацией не подтвердили причинную связь между уровнем РМК и сердечно-сосудистыми исходами. (Таблица 3) [73, 74].
Альтернативным объяснением наблюдаемых связей между гиперурикемией и сердечно-сосудистыми заболеваниями могло быть вмешательство общего этиологического фактора. На эту роль подходит ксантиноксидаза (КО), которая синтезирует свободные радикалы кислорода, которые ингибируют синтез NO и могут привести к повреждению эндотелия [75, 76]. Гипотеза об увеличении активности КО у лиц с гиперурикемией остается бездоказательной из-за трудности дозирования фермента в живых эндотелиальных клетках, и первичная гиперурикемия, как полагают, является результатом недостаточной адаптации почек к уровням растворимой мочевой кислоты. Однако гиперурикемические диетические факторы также могут способствовать первичной гиперурикемии путем повышения активности фермента, который участвует в 2-х последних этапах синтеза мочевой кислоты. Неблагополучные исходы сердечно-сосудистых заболеваний обусловлены скорее повышенной активностью КО, чем уровнем РМК. В соответствии с этой гипотезой, в недавнем проспективном исследовании изучали несколько генных вариантов КO в когорте 2500 европейцев и нашли три минорных аллеля, связанных с повышенным риском гипертензии [77]. Несмотря на то, что остается неизвестным, активностью каких именно ферментов управляют эти аллели, тот же исследователь провел другое пролонгированное исследование когорты 246 голландских детей (средний возраст 7 лет) [78], в котором активность КO, оцениваемая по отношению уровня пуринов к уровню мочевой кислоты, была связана с артериальным давлением. То есть повышение артериального давления, часто наблюдаемое у пациентов с гиперурикемией, может быть обусловлено не уровнем РМК, а усиленной активностью КО [79].
Причинную связь можно изучать еще и путем исследования эффектов лекарственных средств. По результатам большинства недавних ретроспективных исследований типа «случай-контроль» [80–82], но не всех [83], можно предположить, что аллопуринол, особенно в дозе ≥ 300 мг/д, может улучшать исходы сердечно-сосудистых заболеваний у пациентов с бессимптомной гиперурикемией. Однако в этих исследованиях возможна погрешность, потому что назначение аллопуринола часто говорить о лучшем лечении и может сопровождаться приемом колхицина, который, как недавно было показано, эффективен при ишемической болезни сердца [84]. Недавно был проведен обзор рандомизированных контролируемых исследований (РКИ), в котором сравнивали аллопуринол с плацебо [85]. Большинство исследований показали благоприятное воздействие на сердечно-сосудистые заболевания. В недавнем исследовании с участием всего лишь 253 пациентов не удалось показать, что аллопуринол (в дозе 600 мг в сутки) уменьшает проявления сердечной недостаточности, вызванной гиперурикемией [86]. В нескольких небольших РКИ также предположили, что аллопуринол мог замедлить снижение почечной функции у пациентов с гиперурикемией и ХБП [87]. В недавнем одноцентровом РКИ с участием 93 пациентов с гиперурикемической ХБП было показано подобное благоприятное воздействие фебуксостата [88]. Однако такой нефроспротективный эффект фебуксостата не наблюдался в другом недавнем РКИ у больных подагрой с нарушением функции почек умеренной и тяжелой степени тяжести [89].
Самые убедительные результаты были получены в двух маленьких РКИ, в которых прием аллопуринола или пробеницида позволили скорректировать раннюю гипертензию у подростков [90, 91]. Однако эти результаты не могут быть распространены на взрослых; по результатам недавнего РКИ сообщалось, что УСП (уратснижающие препараты) не изменяли артериальное давление [92]. У грызунов вызванная мочевой кислотой гипертензия могла быть скорректирована уратснижающими препаратами только на ранней стадии [93], и неясно, могут ли УСП скорректировать гипертензию у взрослых с длительный гиперурикемией.
Для оценки лечебно-профилактического воздействия терапии бессимптомной гиперурикемии на сердечно-сосудистую систему и почки требуются крупные РКИ с хорошим дизайном.
Влияние сопутствующих заболеваний на ведение больных подагрой
Диагноз и лечение сопутствующих заболеваний
Высокая частота сердечно-сосудистых заболеваний и повышенный риск смерти от них у пациентов с подагрой привел к разработке Европейской антиревматической лигой (EULAR) рекомендаций по систематическому скринингу и лечению пациентов с подагрой с точки зрения сердечно-сосудистых заболеваний и их факторов риска [94]. Даже при том, что была выявлена отрицательная связь между было курением и подагрой [95–97], отказ от курения был включен в рекомендации EULAR из-за увеличенного риска сердечно-сосудистых заболеваний при подагре [94]. Очень важен контроль веса, поскольку он позволяет нормализовать уровень мочевой кислоты в крови и уменьшить проявления метаболического синдрома.
Лекарства, назначаемые для терапии сопутствующих заболеваний, могут влиять на уровень мочевой кислоты. Аспирин в кардиологических дозах повышает уровень мочевой кислоты [98], и начало его приема может сопровождаться приступами подагры [99]. Гипотензивные средства, такие как бета-блокаторы, ингибиторы ангиотензин-превращающего фермента, блокаторы рецепторов к ангиотензину II, кроме лозартана, тиазидные и петлевые диуретики повышают риск развития подагры, и при подагре предпочтительны блокаторы кальциевых каналов и лозартан, обладающие урикозурическим действием [100]*. Пациентам с сердечной недостаточностью часто назначают петлевые диуретики, но их дозу следует ограничивать минимально эффективной. Следует отдавать предпочтение спиронолактону, который не влияет на уровень мочевой кислоты в крови [101].
При дислипидемии можно назначить фенофибрат [102] или аторвостатин [103], которые оказывают уратснижающий эффект. Аналогичным образом, при сахарном диабете 2-го типа следует отдать предпочтение инсулин-снижающим препаратам, потому что инсулин снижает выведение уратов с мочой. Недавно появившиеся ингибиторы ко-транспортера натрия-глюкозы 2 также снижают уровень мочевой кислоты [104].
* данные крупного РКИ показали наличие уратснижающего эффекта у одного из ингибиторов АПФ, рамиприла, что предполагает более широкое его использование при подборе гипотензивной терапии пациентам с подагрой
Влияние сопутствующих заболеваний на лечение воспаления при подагре
Коморбидные состояния могут являться противопоказанием к применению препаратов, которые обычно назначают для купирования острого приступа подагры [105]. Колхицин и НПВП не следует использовать у пациентов с почечной недостаточностью, которым обычно назначают внутрисуставные или системные стероиды. Далее, пациенты с гипертензией и сахарным диабетом 2-го типа могут плохо переносить стероиды, особенно их повторные курсы при частых обострениях. Стало известно, что интерлейкин 1 (ИЛ-1) играет главную роль в развитии воспаления, обусловленного формированием кристаллов моноурата натрия [106], и для снятия приступов подагры, которая плохо поддается стандартному лечению, были предложены блокаторы ИЛ-1. Открытые исследования антагониста рецепторов ИЛ-1 анакинра [107, 108] говорят в пользу его использования по незарегистрированному показанию у пациентов с резистентностью или с противопоказаниями к НПВП, колхицину и стероидам. Канакинумаб, антитело к ИЛ-1β длительного действия, был одобрен Европейским Медицинским Агентством (но не Американским Управлением по контролю за продуктами и лекарствами) после двух РКИ в сравнении с внутримышечным введением триамцинолона ацетонида [109]. EULAR рекомендовала применение блокаторов ИЛ-1 при частых подагрических атаках и при наличии противопоказаний к НПВП, колхицину и стероидам (пероральным или инъекционным) [94]. Еще одно противопоказание — активная инфекция.
Согласно рекомендациями EULAR и Американской коллегии ревматологов (ACR) [94, 110], в первые шесть месяцев УСТ следует назначать малые дозы колхицина, чтобы уменьшить риск обострений, связанных с УСТ. У людей с умеренным или тяжелым нарушением функции почек воздействие колхицина в 2 раза выше [111], то есть пациенты с ХБП, длительно получающие низкие дозы колхицина, подвергаются повышенному риску токсичности [112]. У пациентов с ХБП описана нейромышечная токсичность (обратимая) [113], поэтому у этих пациентов требуется редукция дозы колхицина. У пациентов с почечной недостаточностью необходимо избегать одновременного назначения статинов [114] или лекарств, взаимодействующих с колхицином путем ингибирования цитохрома P450 или 3A4/P-гликопротеина [115].
Влияние сопутствующих заболеваний на проведение уратснижающей терапии
Сопутствующие заболевания также влияют на уратснижающую терапию. Вследствие повышенного риска преждевременной смерти и роста числа сопутствующих заболеваний у больных подагрой со временем [6] EULAR рекомендует назначать УСТ как можно скорее после постановки диагноза подагры [94]. Согласно данным EULAR и ACR, наличие ХБП должно ускорять назначение УСП [94, 110].
Пациентам с сердечной недостаточностью часто назначают фуросемид, который, как было обнаружено, снижает гипоурикемический эффект аллопуринола и повышает концентрацию в крови оксипуринола [116]. Этот парадокс, по-видимому, объясняется недавно описанным дополнительным эффектом аллопуринола — уменьшение экспрессии КO in vitro — который аннулируется при применении фуросемида [117]. Сердечно-сосудистые заболевания, а не мочегонные средства, могут увеличить частоту серьезных кожных побочных реакций (СКПР) на аллопуринол. Действительно, недавнее общенациональное исследование в Тайване показало, что сердечно-сосудистые (и почечные) заболевания повышают риск гиперчувствительности к аллопуринолу, а связь с приемом диуретиков не была подтверждена [118].
Доза аллопуринола для пациентов с ХБП обсуждается европейскими и американскими экспертами по подагре [119, 120]. Большинство национальных агентств уменьшили одобренную максимальную дозу аллопуринола в зависимости от клиренса креатинина после сообщения о связи высоких доз аллопуринола с СКПР у пациентов с ХБП [121]. При таком снижении дозы часто невозможно достичь целевого уровня мочевой кислоты в крови [122].
При разработке рекомендаций эксперты ACR были уверены в минимизации риска путем медленного повышения дозы аллопуринола, как было показано в ретроспективном исследовании типа «случай-контроль» [123] и рекомендовали титрацию дозы аллопуринола выше разрешенной инструкцией при необходимости для достижения целевого уровня мочевой кислоты в крови [110]. Комитет EULAR выбрал более консервативный подход с учетом редкости СКПР [124], вследствие чего сложно установить факторы риска, а также с учетом недавно опубликованного сообщения об увеличении степени тяжести кожных реакций у пациентов с ХБП и стабильными уровнями оксипуринола [125], и наличия альтернативных препаратов, таких как фебуксостат, в инструкции к которому не сказано о необходимости коррекции дозы при почечной недостаточности легкой и умеренной степени тяжести. В рекомендациях EULAR сохранилось ограничение максимальной ежедневной дозы у пациентов ХПН по клиренсу креатинина. Если ограниченная доза не позволяет достигнуть цели, EULAR рекомендует переходить на на альтернативные препараты, например, другие ингибиторы ксантиноксидазы.
Заключение
У больных подагрой часто встречаются заболевания почек и сердечно-сосудистой системы, которые вносят большой вклад в преждевременную смертность, наблюдаемую при этом заболевании. Поэтому пациентов с подагрой следует регулярно обследовать на сердечно-сосудистые и почечные заболевания и наличие факторов риска, которые необходимо учитывать при лечении подагры. Сопутствующие заболевания, особенно почек, и назначаемые для их лечения лекарственные препараты нужно учитывать при выборе препаратов для снятия подагрического воспаления и снижения уровня мочевой кислоты в крови. Наконец, в то время как впечатляющее количество эпидемиологических данных показали связь почечных и сердечно-сосудистых заболеваний с бессимптомной гиперурикемией, причинно-следственная связь между ними неясна, и для оценки благоприятного воздействия лечения бессимптомной гиперурикемии на течение заболеваний сердечно-сосудистой системы и почек требуются крупные РКИ.
Таблица 1
Исследования с менделевской рандомизацией по изучению связи между гиперурикемией и различными сердечно-сосудистыми заболеваниями или факторами их риска с применением аллелей SLCA9 в качестве инструментальных показателей.
| Автор и год издания [ccылка] | Инструментальный показатель | Число участников | Популяция | Основные результаты |
| McKeigues, 2009 г. [63] |
ПЕН |
1017 |
Жители островов Orkney Шотландия |
Нет влияния на метаболический синдром. |
| Parsa, 2012 г. [58] |
ПЕН |
516 |
Амиши | Повышение измеряемого амбулаторно САД на диете со сниженным и высоким содержанием соли |
| Palmer, 2013 г. [62] |
ПЕН |
Более 58 000 Более 10 000 |
Датчане | Нет влияния на АД или развитие ишемической болезни сердца |
| Testa, 2014 г. [61] |
ПЕН |
755 |
Итальянцы, юг Италии | Предиктор прогрессирования ХБП |
| Mallamaci, 2015 г. [59, 60] |
ПЕН |
449 |
Итальянцы, юг Италии | Повышение измеряемого в кабинете врача САД и признаки атеросклероза сонных артерий по данным УЗИ |
Сокращения: ПЕН — полиморфизм единичных нуклеотидов, ХБП — хроническая болезнь почек, САД — систолическое артериальное давление, АД — артериальное давление, УЗИ — ультразвуковое исследование
Таблица 2.
Исследования с применением менделевской рандомизации и показатели генетического риска (ПГР) для изучения причинной связи между гиперурикемией и сердечно-сосудистыми исходами; положительные исследования
| Автор и год [ссылка] | Применяемый ПГР | Число участников | Популяция | Учет плейотропии | Основные результаты |
| Kleber, 2015 г. [64] | 8 ПЕН | 3315 | LURIC, немецкая когорта | Не выявлено плейотропии | Связь со смертью от сердечно-сосудистых заболеваний и внезапной сердечной смертью |
| Yan, 2016 г. [65] | 17 ПЕН 14- исключены |
СД 2-го типа> 3200 | Китай, по методу поперечного среза | Исключение 14 генов, которые плейотропны или с неслучайным распределением | Связь с диабетической макроангиопатией |
Сокращения: ПГР – показатели генетического риска, ПЕН — полиморфизм единичных нуклеотидов, СД — сахарный диабет
Таблица 3
Исследования с менделевской рандомизацией с применением ПГР для объяснения причинной связи между гиперурикемией и исходами сердечно-сосудистых заболеваний; отрицательные исследования.
| Автор год [ссылка] | Инструментальный показатель (ПГР) | Эффект на вариабельность уровня растворенной мочевой кислоты (РМК) | Число участников | Популяция | Учет плейотропии | Основной результат |
| Stark 2009 [73] | 10 ПЕН | ИБС:1473 Контроль :1241 |
Германия | Нет | Нет связи с ИБС | |
| Yang 2010 [66] | 8 ПЕН | 6% | >50 000 | Европа и США | Нет | Связь с подагрой, но не с АД, уровнем глюкозы, ХБП, ИБС |
| Pfister 2011 [67] | 8 ПЕН | СД2: 7504 контроль : 8560 |
Нет связи ПЕН ГШР с искажающими факторами | Нет связи с диабетом | ||
| Hughes 2013 [68] | 5 ПЕН, транспортеры уратов | 2% | >70 000 | Когорты ARIC и FIJS | Вероятно, объясняет полученный результат | Связь с улучшением функции почек |
| Rasheed 2014 [17] | 5 ПЕН, транспортеры уратов | 2% | >70 000 | Когорты ARIC и FIJS | нет | Нет причинной связи с триглицеридами, триглицериды вызывают гиперурикемию. |
| Sedaghat 2015[69] | 30 ПЕН | 2 мг/дл | 5791 | Роттердамская когорта | нет | Отрицательная связь с САД и ДАД сильнее у пациентов, принимавших диуретики |
| Sluijs 2015 [70] | 24 локуса | 4% | >41500 | Европейцы: когорты EOIC interact и DIAGRAM | Нет плейотропнорго эффекта, за исключением влияния сна уровень триглицеридов | Нет связи с диабетом |
| Yan 2016 [65] | 17 ПЕН 14- исключены |
СД2: >32000 | Китайцы, по методу «поперечного среза» | Исключено 14 плейотропных генов или генов с неслучайным распределением | Связь с диабетической макроангиопатией | |
| Keenan 2016 [74] | 28 ПЕН 14 исключены |
СД2: 65000 Контроль: 68000 ИБС: 54500 Контроль: 68275 СН: 4553 Контроль: 19985 ИИ:14800 Контроль: 19900 |
Европа и Южная Азия | Исключено 14 плейотропных гена | Связь с подагрой Нет связи с СД2, ИБС, инсультом, СН. |
|
| White 2016 [72] | 31 ПЕН | > 166000 > 9800 случаев ИБС |
17 наблюдаемых когорт, преимущественно из Великобритании | Многофакторный анализ Менделевская рандомизация с регрессией по Egger |
Многофакторное ОР: 1-1,22 ОР по Egger: 0,92-1,22 |
Сокращения: ИБС — ишемическая болезнь сердца, САД — систолическое артериальное давление, ДАД — диастолическое артериальное давление, АД — артериальное давление, СН — сердечная недостаточность, ПГР — показатель генетического риска, ПЕН — полиморфизм единичных нуклеотидов, ХБП — хроническая болезнь почек, ИС – инсульт, ОР — отношение рисков, СД2 — сахарный диабет 2-го типа, ИИ — ишемический инсульт
Авторы: Бардин Томас (Thomas Bardin) и Ришетт Паскаль (Pascal Richette)
Published online 2017 Jul 3.
doi: 10.1186/s12916-017-0890-9
PMCID: PMC5494879

заведующий лабораторией микрокристаллических артритов ФГБНУ
«Научно-исследовательский институт ревматологии им. В.А. Насоновой», к.м.н
Недавно была опубликована аналитическая статья «Влияние сопутствующих заболеваний на течение подагры и гиперурикемии: новые данные о распространенности и возможностях терапии», целью которой было аккумулировать данные о взаимосвязи гиперурикемии с сердечно-сосудистыми заболеваниями, обменными нарушениями, болезнями почек для оценки возможной пользы от лекарственной терапии асимптоматической гиперурикемии.
Неоднородность позиций разных учёных в отношении этого вопроса весьма широка. От неприятия таковой, — например экспертный комитет Американской коллегии врачей общей практики (American College of Physicians) в 2016 г., опубликовавший собственные рекомендации по управлению подагрой, «не рекомендует начинать длительную уратснижающую терапию у большинства пациентов, перенесших только первый приступ подагрического артрита, или у пациентов с редкими атаками» и советует врачам «до начала уратснижающей терапии обсуждать с пациентами, страдающими регулярными приступами подагрического артрита, пользу, потенциальный вред, стоимость лечения и индивидуальные предпочтения, в том числе сопутствующую профилактику»; до использования лекарственной терапии асимптоматичекой гиперурикемии по факту выявления гиперурикемии. В первом случае использование уратснижающих препаратов максимально лимитируется, контрастируя с обновлёнными рекомендациями Европейской антиревматической лиги, Американской коллегии ревматологов и многих других национальных рекомендаций по лечению подагры, придерживающихся более конкретных формулировок и оговаривающих намного более широкие показания к уратснижающей терапии. Это резко контрастирует и с тенденцией к расширению показаний к подобной терапии, однако ни в одном из них не оговорена возможность превентивного назначения уратснижающих препаратов до дебюта подагры, например, с целью снижения риска сердечно-сосудистых заболеваний и замедления прогрессии почечной недостаточности, хотя этот возможный эффект и упоминается.
Основания для дальнейшего распространения показаний для уратснижающей терапии на собственно гиперурикемию как таковую весьма весомые, так как влияние гиперурикемии на риск развития хронической болезни почек, артериальной гипертензии, эндотелиальной дисфункции, сахарного диабета и др. основан на довольно серьёзной доказательной базе и в статье приведена лишь малая часть работ, подтверждающих данную гипотезу. К сожалению, в меньшей степени это относится к данным о возможности коррекции этих рисков путём применения ингибиторов ксантиноксидазы (аллопуринола и фебуксосата), хотя речь должна идти скорее не о малом числе исследований, а о недостаточном количестве исследуемых в этих работах и, нередко, о недостаточной их длительности, что не всегда позволяет рассматривать в качестве результатов исходы, например, смертность от конкретной патологии, риск развития клинически значимой почечной недостаточности и т.д.
Если же говорить о результатах наиболее качественных исследований, то число тех, которые постулируют возможность модификации перечисленных факторов риска путём применения аллопуринола и фебуксостата несравненно больше чем тех, которые не демонстрируют бенефисного влияния уратснижающей терапии. Не случайно отдельные авторы уже предлагают применять указанные препараты (аллопуринол и фебуксостат) в случае неэффективности немедикаментозных методов лечения (диета, витамин С-содержащие продукты, физическая активность и т.д.) при уровне мочевой кислоты сыворотки выше 480 мкмоль/ь независимо от иных факторов и их аргументы более чем убедительны.
Тем не менее положительной эффект ингибиторов ксантиноксидазы в большей степени доказан в отношении прогрессирования хронической болезни почек и при профилактике сердечно-сосудистых заболеваний и их исходов, прогноза при хронической сердечной недостаточности, тогда как данные относительно влияния такой терапии на показатели АД противоречивы. Таким образом, наиболее правильным представляется путь постепенного расширения показаний для применения ингибиторов ксантиноксидазы при асимптоматической гиперурикемии в отдельных случаях: например, при умеренной стадии хронической болезни почек; ишемической болезни сердца, учитывая возможность антиангинального эффекта аллопуринола; при хронической сердечной недостаточности; наконец, при максимально высоких значениях урикемии (выше 600 мкмоль/л), когда вероятность развития подагры максимально высока.
Уровень доказательности, тем не менее, и в этих случаях на настоящий момент недостаточен для принятия окончательного решения. Однако уже проводимые и планируемые в обозримом будущем крупные рандомизированные плацебо-контролируемые исследования – последнее препятствие на пути к контролю над гиперурикемией.