Georgios Giannopoulos, Christos Angelidis, Spyridon Deftereos

Резюме
Подагра — системное заболевание, характеризующееся образованием и отложением кристаллов моноурата натрия в тканях у лиц с повышенным уровнем мочевой кислоты в сыворотке крови. В последнее время было опубликовано много сообщений, связывающих повышенное содержание мочевой кислоты в сыворотке крови и/или наличие подагры с нарушениями сердечного ритма. В данном обзоре собраны данные о связи наиболее распространенных нарушений ритма и гиперурикемии/подагры, и обсуждаются вопросы, затрагивающие данный аспект. В целом, имеющиеся данные нельзя назвать исчерпывающими, однако они свидетельствуют о наличии взаимосвязи между уровнями мочевой кислоты и нарушениями сердечного ритма. Безусловно, такую связь следует ожидать, учитывая большое количество факторов риска и сопутствующих заболеваний характерных для гиперурикемии / подагры и аритмии. Однако наблюдаемые взаимосвязи, по-видимому, в большинстве исследований сохраняются после тщательной коррекции по потенциально искажающим факторам. Тем не менее, многосторонний анализ эпидемиологически собранных данных не может заменить доказательств, полученных в ходе клинических исследований. Очевидно, что необходимы дальнейшие исследования для установления причинно-следственных связей действия мочевой кислоты и формирования аритмий, а также клинические испытания для изучения терапевтических подходов такой связи. Проще говоря, мы вполне уверены, что взаимосвязь существует, но для доказательства причины все еще не хватает данных.
ВВЕДЕНИЕ
Мочевая кислота является конечным продуктом метаболического распада пуриновых нуклеотидов у человека. При рН артериальной крови 7,40 большая часть мочевой кислоты циркулирует в виде урат-аниона. Гиперурикемией называют концентрацию мочевой кислоты в сыворотке крови 6,8 мг/дл и выше, при которой in vitro образуются кристаллы моноурата натрия при физиологическом рН и температуре тела. Подагра — системное заболевание, характеризующееся образованием и отложением кристаллов моноурата натрия в тканях у лиц с повышенным уровнем мочевой кислоты в сыворотке крови (СМК)[1]. К гиперурикемии могут привести как повышенная продукция, так и недостаточное выведение мочевой кислоты. Основной причиной повышения мочевой кислоты у пациентов с подагрой является недостаточная ее экскреция (Рис. 1). Подагра признана наиболее часто встречающейся причиной воспалительных артритов, которая поражает почти 4% взрослого населения США, при этом эпидемиологические исследования указывают на рост заболеваемости как в развитых, так и в развивающихся странах [2,3]. Типичные клинические проявления заболевания возникают в результате воспалительной реакции на отложение кристаллов моноурата и включают эпизоды мучительной боли, обычно возникающей в одном из периферических суставов, которые чередуются с бессимптомными периодами разной продолжительности. Помимо этих симптомов и прогрессирующей деструкции суставов, вызванной повторяющимися воспалительными повреждениями, гиперурикемия и подагра оказались связаны с целым рядом состояний, включая сердечно-сосудистые заболевания, что в конечном итоге приводит к увеличению смертности [4-6]. В последнее время, растет число сообщений о связи повышенного уровня СМК и/или подагры с нарушениями сердечного ритма. В этом обзоре мы обобщили имеющиеся на сегодняшний день данные о потенциальной связи между нарушениями сердечного ритма и подагрой, и обсуждаем вопросы и противоречия, которые их окружают. Поскольку гиперурикемия является необходимым условием для развития симптоматической подагры, мы также рассмотрели исследования, посвященные этой теме, и обсуждаем терапевтические подходы этой взаимосвязи.
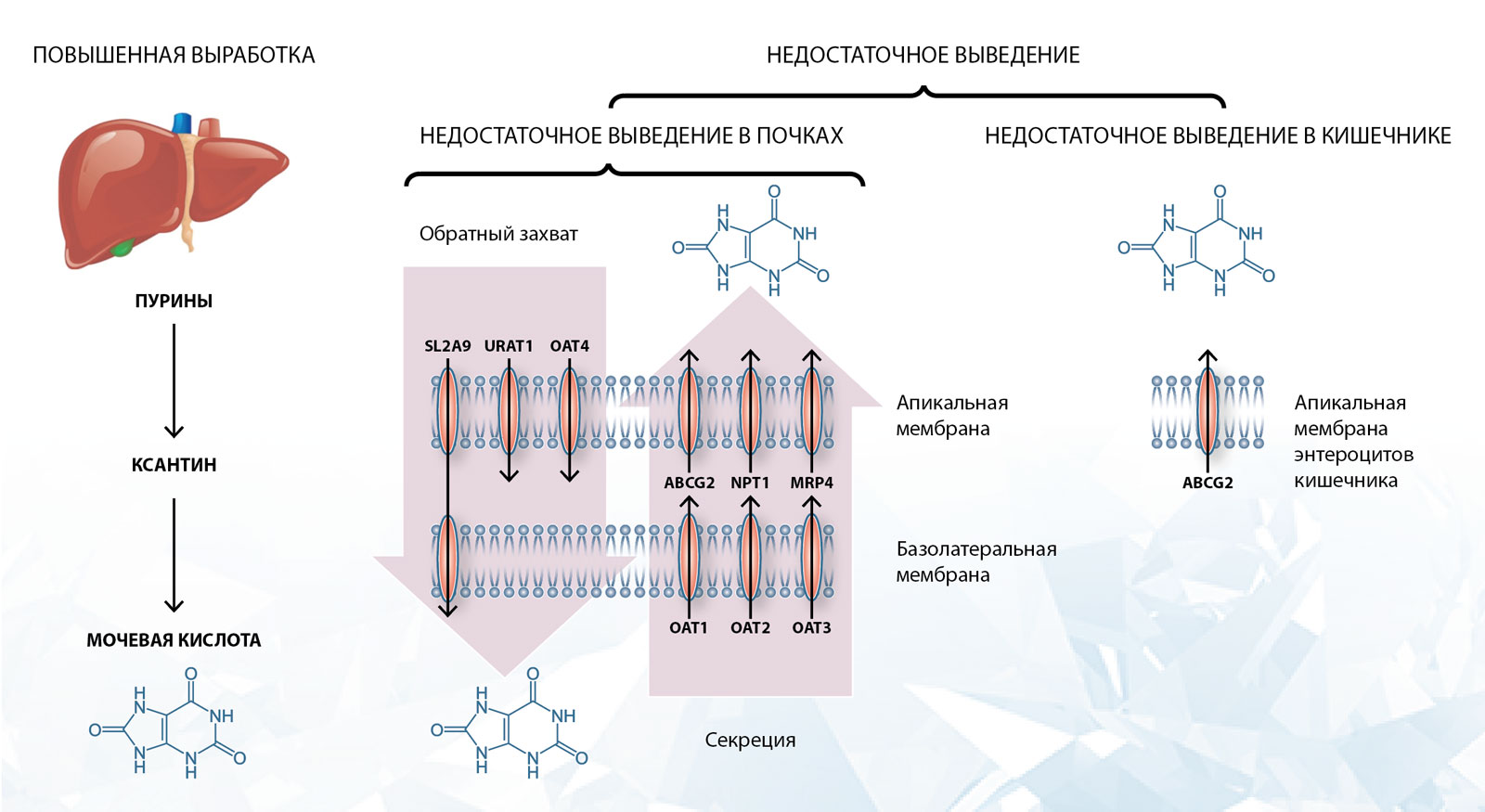
Слева — перепроизводство урата через путь деградации пурина является незначительным фактором, влияющим на концентрацию урата в сыворотке. Недостаточная экскреция урата является основной причиной гиперурикемии у людей с подагрой. В центре — основные компоненты транспортной цепи урата проксимальных канальцев почек сгруппированы в соответствии с их ролью в качестве переносчиков обратного захвата урата из отфильтрованной мочи или в качестве секреторных переносчиков. Справа — транспорт урата в кишечнике (вариации в ABCG2 с уменьшенной экскрецией функциональных блоков способствуют недостаточной экскреции). [Из [1], с разрешения]
Атриальные аритмии
Синусовая тахикардия
Синусовая тахикардия и высокая частота сердечных сокращений в состоянии покоя были взаимосвязаны с высоким уровнем СМК [7].Cicero и др. были проанализированы данные по 1639 пациентам, которые входили в когорту исследования в Бризигелле. В многофакторном анализе, после коррекции потенциально искажающих факторов, высокий уровень СМК был независимо ассоциирован с синусовой тахикардией (соотношение рисков — 2,21; достоверность — 95%; доверительный интервал — 1,05-4,16). Многовариантные соотношения уровней СМК с целым рядом условий может быть связано с высокой частотой сердечных сокращений, что делает довольно трудным статистический учёт всех потенциальных факторов риска.
Фибрилляция предсердий
Кросс-секционные исследования и исследования случай-контроль
Одно из первых исследований, сообщивших о взаимосвязи между повышенным уровнем СМК и ФП, было проведено Letsas и др. [8], в котором изучались данные 86 пациентов с ФП (45 с пароксизмальной и 41 с постоянной ФП), которые находились в отделении неотложной помощи. Контрольная группа состояла из лиц без аритмий в анамнезе, которые проходили регулярное рутинное клиническое обследование.
Уровни СМК достоверно различались между пациентами с пароксизмальной ФП, с постоянной ФП и контрольной группой (Р < 0,001). Многофакторный логистический регрессионный анализ показал достоверную корреляцию между уровнем СМК и постоянной ФП, после поправки на возраст, пол и применение статинов (скорректированное отношение рисков — 2,172; достоверность — 95% доверительный интервал 1,327–3,555, P = 0,002), но не между уровнем СМК и пароксизмальной ФП. Интересно, что эта взаимосвязь не зависела от уровня С-реактивного белка (СРБ). В исследовании Hu и др. о возможной взаимосвязи метаболического синдрома с ФП и предикторами ФП у пожилых пациентов с гипертонией, был отмечен достоверно более высокий уровень СМК у больных ФП (Р = 0,003) [9]. Однако данная взаимосвязь не сохранилась в многофакторном анализе. Lu и др. изучали эту взаимосвязь у пациентов с эссенциальной гипертензией, но без существенных/значимых сопутствующих заболеваний или состояний, которые могли бы повлиять на уровень СМК [10].Как в однофакторном анализе (Р < 0,001), так и после коррекции по возрасту, артериальной гипертензии, функции почек, толщине межжелудочковой перегородки и толщине задней стенки левого желудочка, уровень СМК был связан с ФП (отношение шансов 1,008; 95% доверительный интервал 1,003-1,013, Р = 0,002). В 2012 году Suzuki и др. опубликовали исследование о гендерно-специфических взаимосвязях между ФП и СМК [11]. Исследователи использовали информацию из единого регистра, включающего сведения по 7155 пациентов, и сообщили, что распространенность ФП значительно увеличилась от самой низкой до самой высокой концентрации СМК как у мужчин, так и у женщин (P < 0,001). После коррекции по нескольким взаимодействующим переменным, включая возраст, функцию почек, артериальную гипертензию, сердечную недостаточность, органические заболевания сердца, инсульт и прием некоторых лекарственных препаратов, взаимосвязь оставалась независимой только у женщин. Sun и др. исследовали связь между уровнем СМК и ФП в более крупной выборке сельского населения Китая [12].Данные по 11338 участникам (в возрасте ≥35 лет) были собраны во время однократного посещения клиники, которое включало эхокардиографическую оценку. Гиперурикемия была связана со значительно более высокой распространенностью ФП (2,4 по сравнению с 1,0%; Р < 0,001). После поправки на другие сердечно-сосудистые факторы и факторы риска ФП, связь между СМК и ФП оставалась достоверной (соотношение рисков — 1,94; достоверность — 95%; доверительный интервал — 1,26-3,00; P = 0,003). Однако (в отличие от результатов предыдущего исследования) при учете пола независимая взаимосвязь оставалась достоверной только у мужчин (Р = 0,003), у женщин (Р = 0,235).
Tekin и др. сфокусировали свое внимание на пациентах с сердечной недостаточностью на фоне ишемической болезни сердца (фракция выброса ≤40%)[13]. 363 пациента, включенных в исследование, были разделены на две группы: пациенты с хронической ФП (n = 78) и пациенты с нормальным синусовым ритмом (n = 285). Логистический регрессионный анализ показал, что уровень СМК достоверно и независимо ассоциирован с ФП (отношение шансов 1,27; 95% доверительный интервал 1,06– 1,52, Р = 0,01). Mantovani и др. была изучена взаимосвязь между повышенным уровнем СМК и ФП у больных с сахарным диабетом 2 типа [14]. Большинство случаев госпитализации были связаны с декомпенсированным диабетом, диабетическими язвами стоп и инфекциями. Пациенты со злокачественными новообразованиями были исключены из исследования. Была доступна подробная информация о пациентах по нескольким параметрам (что позволило осуществить многофакторную коррекцию на потенциальные факторы риска). Из 842 пациентов у 91 (10,8%) была постоянная или персистирующая ФП (ни у одного не было пароксизмальной ФП), и у 243 (28,9%) была гиперурикемия. При однофакторном логистическом регрессионном анализе гиперурикемия ассоциировалась с 3,5-кратным повышением риска ФП (нескорректированное отношение рисков — 3,41; достоверность — 95%; доверительный интервал 2,19–5,32, Р < 0,001). Корреляция сохранялась даже после поправки на множественные факторы риска ФП и потенциально искажающие факторы риска. Kuwabara и др. выбрали иной подход и попытались исследовать данную взаимосвязь в относительно здоровой общей популяции [15]. Они провели ретроспективное перекрестное исследование с использованием данных, собранных у субъектов, которые проходили ежегодный периодический медицинский осмотр в международной больнице святого Луки в Токио в период с января 2004 года по июнь 2010 года. После многочисленных корректировок регрессионный анализ показал, что каждое увеличение уровня СМК на 1 мг/дл было связано с на 35% более высокой вероятностью развития ФП (достоверность — 95% доверительный интервал 22-50%). Интересно, что курение не было независимо связано с ФП. После исключения пациентов с хронической болезнью почек, артериальной гипертензией, дислипидемией, сахарным диабетом, с противоподагрической терапией, а также тех, у кого в анамнезе были сердечно-сосудистые заболевания, каждое увеличение уровня СМК на 1 мг/дл было связано с на 53% более высокой вероятностью развития ФП (достоверность — 95%; доверительный интервал 21-92%). Соотношение рисков развития ФП для гиперурикемии составило 2,75 (достоверность — 95%; доверительный интервал 2,10–3,60) у всех лиц и 3,19 (достоверность — 95%; доверительный интервал 1,81–5,62) у субъектов из второй когорты.
Другое крупное одноцентровое перекрестное исследование, проведенное в Японии, включало 285882 субъекта, которым провели рутинный скрининг в период с января 1979 года по декабрь 2013 года[16].Те, кто получал лечение гиперурикемии, были исключены из анализа. Субъекты были стратифицированы на децили по уровню СМК, и распространенность ФП была рассчитана для каждого дециля. Многофакторный логистический регрессионный анализ показал, что уровень СМК был независимо ассоциирован с ФП как у мужчин, так и у женщин (Р < 0,001). Как и в некоторых предыдущих исследованиях, высокий уровень СМК у женщин показал более сильную связь с ФП, чем у мужчин (скорректированное отношение рисков 4,71 против 2,60). Стратификация на децили позволила установить, что низкий уровень СМК (<4,3 мг/дл у мужчин и <3,5 мг/дл у женщин) также был связан с повышенным риском развития ФП.
Недавно Wakula et al. предположили, что у пациентов с пароксизмальной ФП будут выявлены несколько биомаркеров, включая СМК, по сравнению с пациентами с синусовым ритмом [17]. В исследовании приняли участие пациенты с двухкамерными кардиостимуляторами и активированным мониторингом предсердий. В зависимости от истории событий в их кардиостимуляторах, на момент включения в исследование были выделены две группы. Группа с эпизодами высокой предсердной частоты (ЭВПЧ) длительностью ≥6 мин и группа без ЭВПЧ. Из 49 пациентов с выявленной ЭВПЧ были отобраны 19 субъектов с подтвержденной пароксизмальной ФП, самой высокой ЧСС и наиболее длинными эпизодами ЭВПЧ, которые сравнивали с данными 20 пациентов без ЭВПЧ и предсердных аритмий в анамнезе. Однофакторный анализ показал, что уровни СМК не отличались в подгруппах с ЭВПЧ и без ЭВПЧ (критерий Уилкоксона P = 0,2608). Однако размер когорты ограничивает статистический анализ. Кроме того, как и во всех исследованиях с дизайном случай-контроль, всегда существует риск систематической ошибки отбора. В таблице 1 обобщены все перекрёстные и тематические исследования, в которых изучали взаимосвязь уровня СМК с ФП.
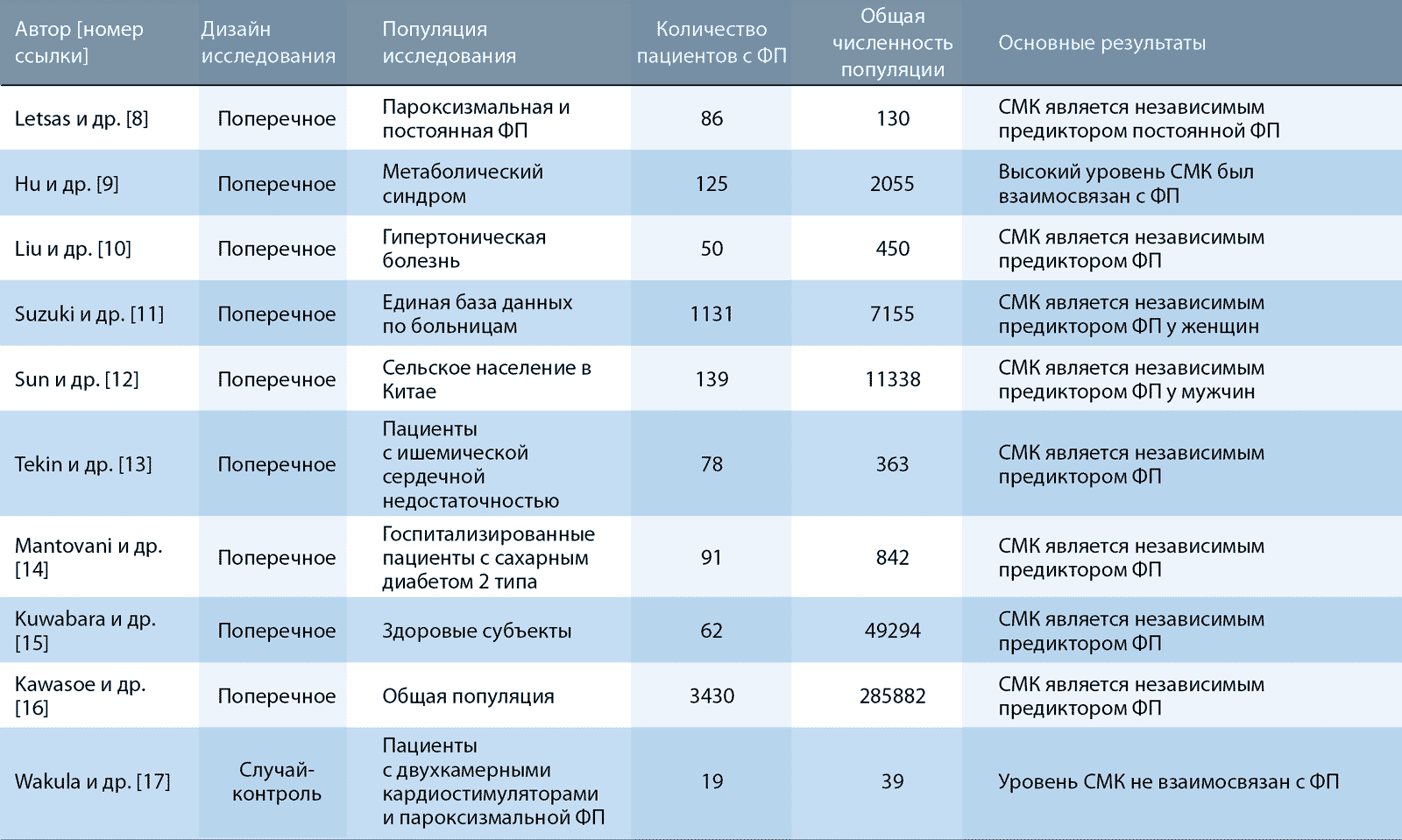
Резюме по поперечным исследованиям и исследованиям случай-контроль, связывающим уровень мочевой кислоты в сыворотке крови (СМК) с фибрилляцией предсердий (ФП).
Проспективные когортные исследования
Первое проспективное исследование в отношении данной проблемы было основано на изучении большой когорты из 15382 чернокожих и белых мужчин и женщин в возрасте от 45 до 64 лет, отобранных в 4 округах Соединенных Штатов [18]. Участники были отобраны из субъектов популяции исследования ARIC (Atherosclerosis Risk In Communities). Основным критерием включения являлся случай ФП. Диагноз был установлен на основании электрокардиограмм (ЭКГ) во время плановых посещений врача, выписок из стационара и/или свидетельств о смерти. За время медианы наблюдения в 16,8 лет ФП была выявлена у 1085 участников. Ее частота была положительно связана с уровнем СМК, с почти трехкратной разницей риска между самым низким и самым высоким квартилем СМК (3/1000 человеко-лет по сравнению с 8/1000 человеко-лет, P < 0,01). После многопараметрической коррекции уровень СМК оставался достоверно связан с риском возникновения ФП (отношение рисков — 1,16; достоверность — 95%; доверительный интервал 1,06–1,26). Однако эта взаимосвязь варьировала в зависимости от расы и пола. Базовый уровень СМК был связан с эпизодами ФП у представителей чернокожей расы, но не у представителей белой расы, и у женщин, но не у мужчин. Цензурирование анализа для субъектов, у которых развилась сердечная недостаточность и инфаркт миокарда (ИМ) до развития ФП, ослабило взаимосвязь между СМК и ФП (отношение рисков 1,07; 95% доверительный интервал 0,97-1,17 на одно стандартное отклонение) и показало, что ассоциация может быть, по крайней мере, частично, объяснена повышенным риском других сердечно-сосудистых заболеваний. В другом когортном исследовании, из Тайваня [19], наличие в анамнезе одного или нескольких эпизодов подагрического артрита в течение периода наблюдения продолжительностью в 6,3 года было связано с более высоким риском ФП (2,1% по сравнению с 1,7% в контрольной группе, P < 0,001). Поправки на возраст и пол не повлияли на достоверность связи с впервые возникшей ФП (отношение рисков 1,191; 95% доверительный интервал 1,098–1,292, P < 0,001). Однако следует отметить низкую приверженность доказательному лечению симптоматической подагры, что свидетельствует о том, что значительный процент пациентов не лечился препаратами, снижающими уровень СМК [20]. В том же году Valbusa и др. продемонстрировали, что высокие уровни СМК имели тесную связь с повышенной частотой развития ФП у пациентов с сахарным диабетом 2 типа [21]. В течение 10 лет наблюдали случайную выборку из 400 больных сахарным диабетом (средний возраст 65 лет) без трепетаний предсердий/ФП. Гиперурикемия наблюдалась у 73 пациентов. В ходе последующего наблюдения было зарегистрировано 42 случая ФП. Увеличение уровня СМК было связано с повышенным риском возникновения ФП (соотношение рисков — 2,43, достоверность — 95%; доверительный интервал 1,8-3,4, P < 0,0001 на стандартное отклонение увеличения уровня СМК). После коррекции по ряду факторов риска для сердечно-сосудистых заболеваний и ФП, электрокардиографическим особенностям, применению диуретиков и аллопуринола, связь оставалась достоверной (скорректированное соотношение рисков 2,44, достоверность — 95%; доверительный интервал 1,6-3,9, Р < 0,0001). Результаты оставались в значительной степени неизменными даже когда пациенты с наличием в анамнезе ишемической болезни сердца или сердечной недостаточности были исключены из анализа.
Chuang и др. исследовали взаимосвязь между гиперурикемией и ФП в когорте пожилых (65 лет и старше) жителей Тайваня [22]. С этой целью были проанализированы данные, собранные в ходе общенационального опроса 1485 негоспитализированных лиц без ФП. В течение медианы периода наблюдения 9,16 лет гиперурикемия была связана со значительно более высокой частотой развития ФП (Р = 0,049).
В исследовании Tromso изучалась взаимосвязь между уровнем СМК и случаями ФП в общей популяции белого населения североевропейского происхождения [23].Среди 6308 участников частота ФП составила 7,26 на 1000 человеко-лет (достоверность — 95% доверительный интервал 6,36–8,16) у женщин и 9,60 (достоверность — 95% доверительный интервал 8,56–10,64) у мужчин. Средний период наблюдения составил 10,8 лет. В многопараметрическом анализе одно стандартное отклонение повышения уровня СМК было связано с увеличением риска на 17% у мужчин и на 40% у женщин (хоть взаимосвязь оказалась более отчетливой у женщин, зависимость от пола не была достоверной, Р = 0,46). Включение уровня С-реактивного белка в ковариаты не изменило результатов, подразумевая, что взаимосвязь, по крайней мере, в настоящем исследовании, не была обусловлена воспалительным процессом. Kuo и др. сфокусировали свое внимание на пациентах с подагрой в исследовании со смешанным дизайном (сочетающим характеристики исследований случай-контроль/поперечного/когортного)[20]. Была использована информация из базы данных Data Link для клинической практики в Великобритании с целью изучения риска развития ФП на момент впервые установленного диагноза подагры по сравнению с контролем. Всего в анализ были включены 45328 больных подагрой и равное количество субъектов контроля. Доля лиц с ФП на момент даты индексации была достоверно выше среди больных подагрой, нежели в контрольной группе (7,42% по сравнению с 2,83%, Р < 0,001). После рассмотрения нескольких ковариат подагра все еще ассоциировалась с повышенным риском развития ФП (скорректированное отношение рисков — 1,45; достоверность — 95%; ДИ 1,29-1,62). В течение медианы последующего наблюдения, составившей 9 лет, на всех этапах со дня индексации, кумулятивная вероятность возникновения ФП была значительно выше у пациентов с подагрой, чем в контрольной группе (логарифмический ранговый критерий P < 0,001). Скорректированное соотношение рисков составило 1,09 (вероятность 95% доверительный интервал 1,03–1,16). Оценка соотношения рисков была одинаковой у мужчин и женщин.
Корреляция между ФП и подагрой также была изучена Kim и др. [24].В качестве контроля были выбраны две разные популяции субъектов, не страдающих подагрой. Первичное сравнение проводилось с популяцией больных остеоартрозом. Остеоартроз был выбран с целью минимизации осложнений, связанных с ожирением, сопутствующими заболеваниями и интенсивностью использования медицинской помощи, так как эти характеристики аналогичны таковым в группе подагры. Второе сравнение проводилось с группой пациентов, у которых не была диагностирована подагра в начале исследования. В обеих группах сравнения применялись одни и те же критерии исключения. Заключительное исследование включало 70015 пациентов с подагрой и 210045 больных остеоартрозом. Среднее время наблюдения составило 2,1 года для больных подагрой и 2,0 года для больных остеоартрозом. Частота возникновения ФП составила 7,19 на 1000 человеко-лет при подагре и 5,87 на 1000 человеко-лет у больных остеоартрозом. После корректировки по нескольким переменным соотношение рисков для ФП, связанных с подагрой, составило 1,13 (95% ДИ 1,04– 1,23). Вторичное сравнение было проведено между данными 91976 пациентов с подагрой и 275928 пациентов без подагры. После корректировки более чем 35 ковариат, риск возникновения ФП, связанный с подагрой (отношение рисков 1,21, 95% ДИ 1,11–1,33), оставался выше при подагре по сравнению с пациентами без подагры. Авторы пришли к выводу, что подагра имеет взаимосвязь с повышенным риском возникновения ФП по сравнению с остеоартритом и отсутствием подагры. Из-за существенных последствий ФП данная взаимосвязь может оказать важное влияние на популяцию больных подагрой. В таблице 2 обобщены все проспективные когортные исследования, связывающие повышенный уровень СМК и/или подагру с ФП.
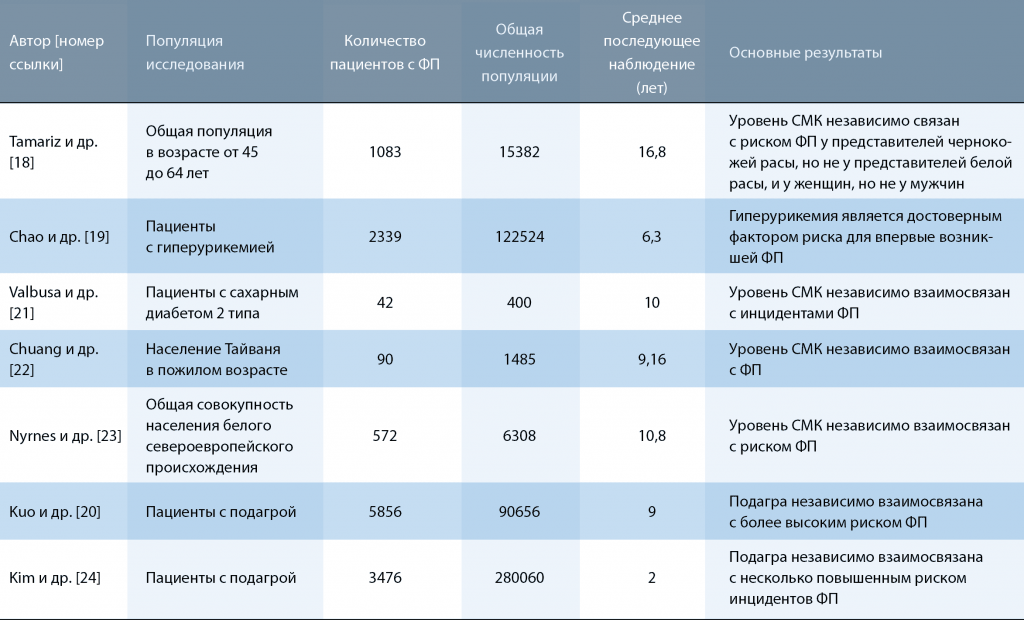
Резюме по проспективным когортным исследованиям, связывающим уровень мочевой кислоты в сыворотке крови (СМК) с фибрилляцией предсердий (ФП).
Метаанализы
На определение взаимосвязи между уровнем СМК и ФП были направлены три метаанализа. В 2013 году Tamariz и др. провели поиск соответствующих публикаций в базе данных MED-LINE (с 1966-2013 гг.) [25].Критериями включения соответствовали шесть перекрестных и три когортных исследования. В перекрестных исследованиях данные по 1603 пациентам с ФП сравнивались с данными 6327 лиц без ФП. Объединенная стандартизированная средняя разница уровня СМК для пациентов с ФП составила 0,42 (Достоверность — 95% ДИ 0,27–0,58). Три когортных исследования включали 138306 субъектов без ФП в исходной точке и 3466 человек, у которых развилась ФП в течение медианы наблюдения, составившей 12 лет. Средний возраст представителей популяции составил 54 года. Общий относительный риск возникновения ФП для лиц с высоким уровнем СМК составил 1,67 (Достоверность — 95% доверительный интервал 1,23–2,27). Авторы пришли к выводу, что существует четкая взаимосвязь между ФП и повышенным уровнем СМК. Неясным остался тот факт, представляет ли СМК из себя всего лишь маркер заболевания, или является терапевтической мишенью.
Несколько лет спустя, Xu и др. включили в другой метаанализ 7 когортных исследований с общим числом участников 146792 [26]. Литературные сведенья были взяты в базах данных PubMed, Embase и Web of Science. В пяти исследованиях оценивалось влияние гиперурикемии на частоту впервые возникшей ФП, в двух исследованиях оценивалось влияние гиперурикемии на рецидив ФП у пациентов после катетерной абляции. Метаанализ всех 7 исследований показал, что гиперурикемия достоверно и независимо ассоциирована с повышенным риском развития ФП (скорректированный относительный риск 1,80, достоверность — 95%; доверительный интервал 1,37–2,38, Р < 0,001). Для гиперурикемии была показана достоверная связь с повышенным риском как впервые возникшей ФП (скорректированный относительный риск 1,66, достоверность — 95%; доверительный интервал 1,22–2,26, Р = 0,001), так и рецидива ФП (скорректированное ОР = 2,07, достоверность — 95%; доверительный интервал 1,61–2,67, Р < 0,001).
Последний из трех метаанализов включал только проспективные исследования [27]. В октябре 2016 года были завершены поиски в базах данных PubMed и Embase и ручной поиск в отдельных журналах. В итоге было отобрано шесть исследований с участием в общей сложности 426159 субъектов. Период наблюдения составил от 2 до 16,8 лет. Гиперурикемия в значительной степени была связана с повышенным риском развития ФП (относительный риск 1,49; достоверность — 95% ДИ 1,24–1,79, Р < 0,001). В анализе чувствительности, при последовательном пренебрежении результатами каждого исследования, не было выявлено существенных изменений в объединенных оценках риска.
Рецидив фибрилляции предсердий после процедуры абляции
Прогностическая значимость повышенного уровня СМК в исходах абляции ФП изучалась только в двух исследованиях. Еще в двух исследованиях, в которых исследователи сфокусировали внимание на других параметрах, были представлены относительные данные (получены и проанализированы базовые значения уровня СМК). Первоначальные результаты научных наблюдений такого взаимодействия было сообщено Letsas и др. [28]. Авторы стремились исследовать влияние индекса массы тела на эффективность и безопасность радиочастотной катетерной абляции при ФП. Был проведен ретроспективный анализ данных по 226 пациентам (183 мужчины) с впервые выявленной пароксизмальной или персистирующей ФП, которым проводилась изоляция легочных вен (ИЛВ). Пациенты с рецидивом ФП чаще других имели повышенный уровень СМК (Р = 0,008). В одномерном регрессионном анализе Кокса уровень СМК был одним из предикторов рецидива ФП (отношение рисков 1,194; достоверность — 95%; доверительный интервал 1,017–1,402, P = 0,030). В многофакторном регрессионном анализе Кокса уровни фибриногена и СМК (отношение рисков 1,167; достоверность 95%; доверительный интервал 1,000-1,361, P = 0,05) были единственными независимыми предикторами рецидива ФП. He и др. проанализировали данные 330 пациентов с пароксизмальной ФП, перенесшим ИЛВ [29]. Пациенты были разделены на квартили на основании дооперационного уровня СМК. От самого низкого квартиля до самого высокого квартиля частота рецидивов составила 16,0%, 26,4%, 28,3% и 29,3% соответственно (Р = 0,014). После поправок по нескольким факторам у субъектов в самом высоком квартиле уровня СМК по сравнению с субъектами в самом низком квартиле сохранялся повышенный риск рецидива ФП (отношение рисков 2,804; достоверность — 95% доверительный интервал 1,466–5,362, Р = 0,002). Положительная взаимосвязь была также продемонстрирована Canpolat и др. [30]. Процедура криоабляции была выполнена у 363 пациентов с впервые выявленном пароксизмом фибрилляции предсердий. Как и в предыдущем исследовании, они были разделены на квартили по исходному дооперационному уровню СМК. Частота рецидивов от самого низкого до самого высокого квартилей составила 2,9%, 7,4%, 11,8% и 77,9% соответственно (Р < 0,001). После проведения многофакторного регрессионного анализа пропорциональных рисков Кокса среди независимых предикторов рецидива ФП был выявлен предабляционный уровень СМК (отношение рисков 1,96; 95% доверительный интервал 1,49-2,59, P < 0,0001). С другой стороны, Guo и др., изучавшие влияние соотношения нейтрофилов/лимфоцитов на прогноз у пациентов с ФП после катетерной абляции, сообщили, что СМК не коррелирует с рецидивом аритмии [31].
Желудочковые аритмии
С точки зрения взаимосвязи между повышенными уровнями СМК и желудочковыми аритмиями, доказательная база является скудной. Из нескольких исследований только в одном этот вопрос рассматривался в соответствии с протоколом, а остальные предоставляли лишь косвенные доказательства возможной взаимосвязи. Еще в 1985 году, исследуя потенциальное аритмогенное влияние от применения диуретиков, McDonald и др. заметили связь между уровнем СМК и наличием желудочковой экстрасистолии [32]. Авторы предположили, что это может быть связано либо с самими препаратами, либо с сопутствующими заболеваниями изучаемой популяции, либо, в качестве альтернативы, это может быть обусловлено прямым причинным влиянием на миокард желудочков. Yamada и др. исследовали взаимосвязь между повышением уровня СМК и возникновением желудочковой тахикардии (ЖТ) у пациентов с гипертрофией левого желудочка [33]. В этом небольшом обсервационном исследовании 167 человек с эхокардиографическими признаками гипертрофии (толщина межжелудочковой перегородки и задней стенки >12 мм) были разделены на две группы в зависимости от того, была ли обнаружена ЖТ (определяемая как 5 или более последовательных желудочковых сокращений) на 24-часовой записи ЭКГ. Многовариантный регрессионный анализ показал, что уровень СМК является единственным независимым фактором, связанным с появлением ЖТ (отношение шансов 1,61; 95% доверительный интервал 1,18–2,22; Р < 0,01). Недавно Singh и Cleveland исследовали, связано ли применение аллопуринола со снижением риска желудочковых аритмий [34]. С этой целью была использована случайная выборка из базы Medicare. Было изучено 28775 случаев первого применения аллопуринола, при этом подагра являлась основным диагнозом в 74% случаев. Многовариантно скорректированные анализы показали, что по сравнению с отсутствием терапии аллопуринолом, его применение связано с коэффициентом рисков желудочковой аритмии 0,82 (достоверность — 95% доверительный интервал 0,76-0,90), а более длительные периоды приема аллопуринола были достоверно связаны с более низким коэффициентом риска, скорректированных с учетом нескольких переменных [1 до 180 дней — 0,96 (достоверность — 95% доверительный интервал 0,85–1,08); от 181 дня до 2 лет — 0,76 (достоверность — 95%; доверительный интервал 0,68-0,85); и >2 лет — 0,72 (достоверность — 95%; доверительный интервал 0,60–0,87)]. Примечательно, что это явление также имело место в том случае, если анализ был ограничен пациентами, не получавшими антиаритмические или кардиопротекторные препараты. Фактически, для пациентов без ишемической болезни сердца снижение риска составило 38% против 13% для пациентов с ишемической болезнью сердца. Поправки по известным факторам риска дали аналогичные результаты. По-видимому, длительное применение аллопуринола (>6 месяцев) влияет на патофизиологические механизмы, уменьшая уязвимость миокарда желудочков в отношении аритмий, предположительно через сопутствующее снижение уровня СМК, а не (по крайней мере, не только) через не выявленное прямое антиаритмическое действие (в этом случае результаты были бы очевидны сразу после начала лечения).
Патофизиологические аспекты
Несмотря на значительный прогресс, достигнутый за последнее десятилетие в понимании патогенеза подагры, до сих пор неясно, каким образом (и есть ли это явление вообще) мочевая кислота может способствовать развитию ФП и ее поддержанию. Поскольку данные об этой взаимосвязи получены главным образом из эпидемиологических исследований, можно только предполагать о патофизиологических механизмах, связывающих эти два состояния.
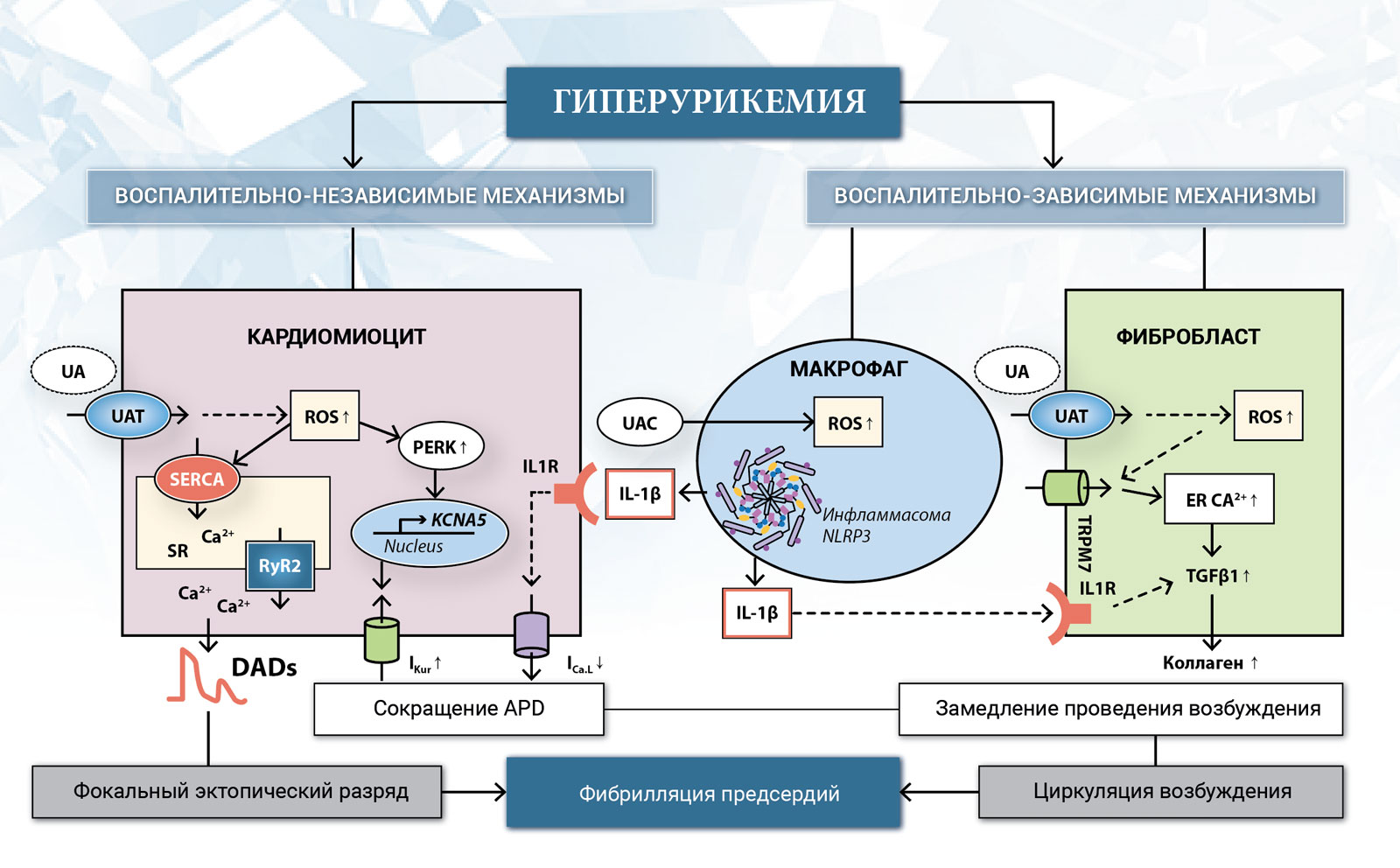
Предполагаемые механизмы фибрилляции предсердий, вызванной гиперурикемией.
APD ‒ длительность потенциала действия; DADs ‒ отсроченные после деполяризации; ER ‒ эндоплазматическая сеть; IKur ‒ предсердный сверхбыстрый отсроченный K⁺-канал; ICa,L ‒ L-тип Ca ²⁺-канала; IL-1 β ‒ интерлейкин-1 β; ILR ‒ рецептор интерлейкина; KCNA5 ‒ ген, кодирующий потенциал-управляемое подсемейство калиевых каналов A, тип 5; NLRP3 ‒ нуклеотидсвязывающий домен, содержащий лейцин-насыщенный повтор, содержащий белок 3; RyR2 ‒ рианодиновый рецептор типа-2; SERCA ‒ саркоплазматическая сеть (SR) Ca²⁺ -АТФаза; ROS ‒ активные формы кислорода; TGF β1 ‒ трансформирующий фактор роста β1; pERK ‒ фосфорилированная (активированная) внеклеточная сигнальная регулируемая киназа; UA ‒ мочевая кислота; UAC ‒ кристалл мочевой кислоты; UAT ‒ транспортер мочевой кислоты. Сплошные линии указывают на проверенные механизмы, а штриховые линии указывают на предполагаемые пути. (изменено в [35], с разрешения).
Теоретически свою роль могут играть как воспалительно-зависимые, так и воспалительно-независимые механизмы (Рис. 2) [35]. Центральное место в воспалительно-зависимых механизмах занимает активация нуклеотид-связывающего домена инфламмасомы белка 3, содержащего богатые лейцином повторы (NLRP3), приводящая к продукции и высвобождению интерлейкина-1 β (IL-1 β). Секретируемый IL-1 β может стимулировать пролиферацию и дифференцировку фибробластов в миофибробласты, которые в свою очередь высвобождают большое количество цитокинов, включая трансформирующий фактор роста β1 (TGF β1), способствующий фиброзу. Фиброз предсердий может быть обусловлен воздействием активных форм кислорода на Ca2+- проницаемый катионный канал TRPM7 [36]. Как бы то ни было, структурное ремоделирование способствует развитию реципрокных контуров и сохранению аритмии. Воспалительно-независимые пути могут влиять на длительность потенциала действия предсердных клеток через активацию белков канала Kv1.5, увеличивая сверхбыстрый калиевый ток (I Kur) [37].Кроме того, IL-1 β может непосредственно подавлять ток Ca2 + L-типа (I Ca, L) путем воздействия на рецепторы IL-1 [38]. Оба влияния (увеличенный I Kur и уменьшенный I Ca ,L) могут привести к сокращению длительности потенциала действия, обеспечивая поддержание ФП. Электрическое ремоделирование также может быть опосредовано взаимодействием между NLRP3-инфламмасомой и Ca2+- АТФазой саркоплазматического ретикулума, что способствует замедленной постдеполяризации и, следовательно, к электрической нестабильности [39,40]. Другие возможные механизмы могут задействовать ренин-ангиотензин-альдостероновую систему [41]. Однако следует иметь в виду, что ФП имеет сложное патофизиологическое происхождение. Обсуждаемые патофизиологические пути являются теоретическими рассуждениями, которые пытаются связать ограниченные доступные данные из исследований на животных и гипотезу с конечным результатом.
Терапевтическое значение и последующие перспективы
При рассмотрении представленных исследований в совокупности становится очевидным, что гиперурикемия /подагра и сердечно-сосудистые заболевания имеют несколько общих факторов риска. Поэтому лицам с гиперурикемией/подагрой необходимо систематически проходить скрининг на наличие сердечно-сосудистых заболеваний и факторов риска, которые должны рассматриваться как важный аспект при лечении. Внедрение актуальных руководств с упором на уратснижающую терапию и тщательный мониторинг терапевтических мишеней должны способствовать улучшению результатов, хотя это еще не было убедительно и научно продемонстрировано в клинических исследованиях, особенно в отношении аритмий. Следует отметить, что имеются данные о недостаточной приверженности со стороны врачей к доказательному лечению этих состояний [20,42].Что касается связи между гиперурикемией/подагрой и аритмиями, то, несмотря на многочисленные эпидемиологические исследования, посвященные этому вопросу, существует поразительно мало исследований влияния фармакологических вмешательств на клинические исходы. Следовательно, существует неудовлетворенная потребность в новых исследованиях, предпочтительно в форме больших рандомизированных контролируемых исследований, для изучения влияния уратснижающей терапии на аритмии, проверки гипотезы о причинно-следственной взаимосвязи между гиперурикемией и нарушениями ритма и выяснения практической роли данных с точки зрения патофизиологии для данных методов лечения. Поскольку данные эпидемиологических исследований позволяют предполагать, что повышение уровня СМК независимо связаны с риском развития ФП, теоретически аллопуринол и другие урат-снижающие препараты могут быть исследованы в отношении предотвращения ФП у пациентов с бессимптомной гиперурикемией и сопутствующими состояниями (включая пациентов после операции коронарного шунтирования) или в отношении предотвращения рецидива ФП после процедур абляции. Другая большая группа пациентов, где редко встречаются данные по качеству проводимого лечения, включает пациентов с ИБС. Желудочковые аритмии являются основной причиной заболеваемости и смертности у пациентов с ИБС, и, учитывая высокую распространенность ИБС, даже незначительные корреляции между уровнями СМК и желудочковыми аритмиями – и, что более важно, столь же незначительные терапевтические эффекты — могут иметь значительную клиническую ценность.Наконец, необходимо больше данных не только по пациентам, но и со стороны лабораторных исследований. Предполагаемые каскады действия, такие как предложенные Li и Dobrev (рис. 2) [35] или Maharini и др. [41], а также другие, пока неизвестные, должны быть тщательно изучены в попытке обнаружить молекулярные механизмы, которые могли бы лежать в основе связи между гиперурикемией и аритмией, если такие механизмы действительно существуют.
выводы
Имеющиеся данные нельзя назвать исчерпывающими, но они убедительно свидетельствуют о положительной корреляции между уровнями СМК и общими нарушениями сердечного ритма. Безусловно, такую связь следует ожидать, учитывая большое количество факторов риска и сопутствующих заболеваний характерных для гиперурикемии / подагры и аритмии. Однако наблюдаемые взаимосвязи, по-видимому, в большинстве исследований сохраняются после тщательной коррекции по потенциально искажающим факторам. Тем не менее, многофакторный анализ эпидемиологически собранных данных является всего лишь математическим инструментом и ни при каких обстоятельствах не может заменить доказательства, полученные в ходе фундаментальных и клинических исследований. Очевидно, что необходимы дальнейшие исследования для установления причинно-следственной связи между действием мочевой кислоты и возникновением аритмий, а также клинические испытания для изучения терапевтических возможностей таких сочетаний. Проще говоря, мы вполне уверены, что взаимосвязь существует, но доказать причины пока не представляется возможным.
© 2018 Elsevier Inc. Все права сохранены.
Ключевые слова: аритмия, фибрилляция предсердий, подагра, гиперурикемия, желудочковая аритмия.




